Metody sterilní práce, očkování a uchovávání mikroorganizmů
Cíl cvičení
Naučit se zásady aseptické práce a dodržovat je při práci s mikroorganizmy. Zvládnutí techniky očkování mikroorganizmů (tekutá i tuhá média). Izolace jednotlivých kolonií pomocí křížového roztěru.
Úvodní slovo
Jako kultury označujeme mikroorganizmy kultivované v laboratorních podmínkách na živných médiích. Pracujeme-li s kulturou jednoho druhu, považujeme ji za kulturu čistou. Kultury smíšené jsou kultury několika druhů (např. izoláty z přirozeného prostředí, které je potřeba kultivací pro identifikaci oddělit = izolovat). Jako kultury technické se označují kultury používané pro výzkumné nebo provozní účely (v čistírnách odpadních vod, bakteriální filtry, bioreaktory). Technické kultury mohou být jak čisté (pivovarské kvasinky), tak smíšené (mléčné bakterie pro výrobu jogurtů).
Kultury přenášíme (= přeočkováváme) na čerstvé médium z tekutého nebo z tuhého média za různými účely: přenesení do čerstvějšího média, oživení, očkování na diagnostické médium, izolace kultury, očkování pro odečet fyziologických a morfologických vlastností kultury. Charakter růstu a podmínky následné kultivace jednotlivých kultur se v laboratoři (optimální podmínky – čistá kultura, dostatek živin) vždy odlišují od růstu dané kultury v přirozeném prostředí. Růst v přirozeném prostředí doprovází kompetence o živiny, adaptace a neustálý boj s antibiotiky a metabolity současně přítomných dalších kmenů. Navíc je třeba si uvědomit, že mnoho bakteriálních druhů je nekultivovatelných.
Izolace bakteriálního kmene
Pro zisk čisté kultury jsou využívána selektivní média, na kterých vyroste pouze žádaný bakteriální taxon či skupina taxonů (druh, rod). Pro izolaci kmene na Petriho misce na selektivním nebo na neselektivním (univerzálním) médiu využíváme metodu křížového roztěru. Podle vzhledu vyrostlých kolonií lze odlišit různé morfologické typy a ty následně izolovat dalším křížovým roztěrem (odebráním buněk z dané kolonie). Křížový roztěr je metoda postupného zřeďování původní kultury za účelem zisku jednotlivých kolonií a odečtení jejich morfologie. Kolonie mikroorganizmů je ve své podstatě klon jedné buňky. Bakteriologická klička s přenášenou kulturou se po každém kroku očkování žíhá v plamenu, tím dojde k usmrcení buněk a při dalším tahu pak po agaru roztíráme pouze buňky setřené z následující oblasti křížového roztěru. Roztírá se stále menší množství buněk. V místě tzv. hádku (poslední oblast křížového roztěru) již vyrůstají jednotlivé kolonie, u kterých lze hodnotit charakteristický profil, vzhled, tvar, barvu, okraje.
Kultivace
Kultury v tekutém médiu můžeme kultivovat kontinuálně (např. větší objemy média s průmyslovými kmeny). Příkladem je chemostat, kdy je růstová rychlost kultury řízena koncentrací limitující živiny, která je přítokem nového média dodávána. Naočkujeme-li médium, do kterého již nejsou dodávány živiny, jedná se o kultivaci statickou. Statická kultivace může být submerzní (třepaná) nebo vzdušněná. Těmito procesy se promícháváním zvětšuje plocha fázového rozhraní a může probíhat efektivnější výměna plynů (např. provzdušňovací rošty v bioreaktorech).
Vzhled kultury ovlivňuje použité médium, typ kultivace i stáří kultury. Stejný mikroorganizmus může na různých typech agarů vykazovat různé morfologické vlastnosti (pigmentace, velikost kolonií, atd.).
Při práci s čistými kulturami, v našem případě z České sbírky mikroorganizmů, (http://www.sci.muni.cz/ccm/), dodržujeme podmínky kultivace dle katalogu kultur – doporučené médium definovaného složení, teplota a podmínky kultivace. Pokud izolujeme kmeny z prostředí, snažíme se dodržet podmínky, které jsou pro ně v daném prostředí přirozené (koncentrace solí, živin, teplota, pH).
Růstová křivka (obr. 2)
je grafické vyjádření závislosti počtu buněk na délce statické kultivace a skládá se z několika fází:
Lag fáze
probíhá přizpůsobování a růst samotné buňky, aktivace vhodných enzymů, organizace metabolizmu. V činnosti jsou adaptivní enzymy, v buňce je přítomno mnoho RNA (zvýšená syntéza enzymů), řada ještě neadaptovaných buněk odumírá.Fáze fyziologického mládí (zrychleného růstu)
bod mezi lag a log fází; všechny potřebné enzymy jsou připraveny a kultura vykazuje vysokou rychlost růstu.Log fáze (logaritmická, exponenciální)
intenzivní růst buňky a metabolizmus, trvá, dokud není koncentrace živin limitující, všechny buňky se dělí konstantní maximální rychlostí. Z této části křivky se využívají parametry pro srovnávání experimentů. Buňky lze dobře charakterizovat, charakter růstu se odečítá vždy v log fázi (suchá a mokrá hmotnost buněk, nárůst metabolitů, stanovení váhy DNA, RNA).Fáze zpomaleného růstu
snížení intenzity metabolizmu, hromadění metabolitůFáze stacionární
snížení rychlosti množení, počet nově vzniklých buněk se vyrovnává s počtem odumřelých, dochází k vyčerpání živin, délka života závisí na citlivosti k hladovění, mohou vznikat endosporyFáze odumírání
médium je spotřebováno a buňka odbourává své zásobní látky, čelí kyselosti prostředí (ze svých zplodin), nestačí reparační systémy
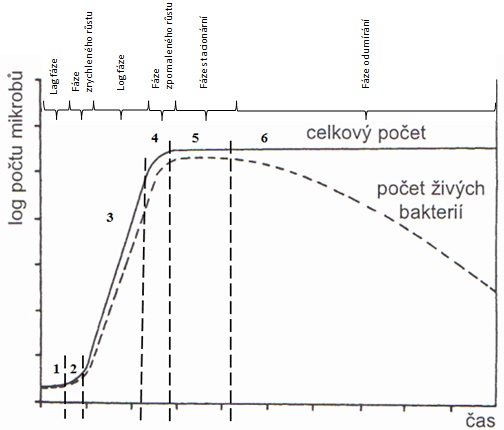
Diauxie je postupné využívání dvou substrátů. Nejdříve se využije jednoduchý zdroj, např. glukóza, a potom teprve složitější substrát, např. laktóza. Růstová křivka má v tom případě dva vrcholy.
Teplota
Podle optimální teploty kultivace rozlišujeme tři základní skupiny mikroorganizmů: psychrofilní s optimem růstu pod 20 °C (oceány, jeskyně, chladnička – např. pseudomonády, aeromonády, listerie); mezofilní s optimem růstu mezi 20 až 40 °C (většina bakteriálních druhů; parazitické mikroorganizmy); termofilní s optimem růstu nad 55 °C (extrémní termofilové rostou až kolem 100 °C).
Vztah ke kyslíku
Bakteriální druhy kultivované za přístupu vzduchu označujeme jako aerobní. Podmínky aerobní kultivace jsou zajištěny na povrchu agarových médií či ve zkumavkách s nízkým sloupcem tekutého média při inkubaci v běžné atmosféře. Větší objemy tekutého média by již musely být syceny kyslíkem (aerace, submerzní kultivace). Některé střevní bakterie jsou příkladem fakultativních anaerobů, které jsou schopny růstu jak v aerobním, tak anaerobním prostředí. V prostředí s kyslíkem přepínají na energeticky výhodnější aerobní metabolizmus. V tekutém médiu se projevují růstem v celém jeho sloupci (zákal média). Anaerobní organizmy se vyskytují v prostředí s nulovou či nízkou koncentrací kyslíku, kyslík působí jako jed či inhibitor růstu. Stav anaerobiózy jako první definoval Louis Pasteur, který zavedl do mikrobiologie termíny pro aerobní a anaerobní organizmy. V závislosti na stupni tolerance vůči molekulárnímu kyslíku, lze anaerobní mikroorganizmy dělit na: striktně (obligátně) anaerobní mikroorganizmy – vyžadují úplnou absenci kyslíku, koncentrace více než 0,5 % na ně působí toxicky a odumírají; aerotolerantní mikroorganizmy – nevyužívají kyslík jako konečný akceptor elektronů, ale rostou v jeho nízkých koncentracích; mikroaerofilní mikroorganizmy – vyžadují určité nízké procento kyslíku, využívají ho jako konečný akceptor elektronů, ale nerostou za přítomnosti 21 % vzdušného kyslíku za normálního tlaku.
Anaerobní nebo mikroaerofilní kultivace se provádí hlubokým vpichem do agaru nebo očkováním do vysoké vrstvy kapalného média. Je nutno snížit oxidoredukční potenciál přidáním redukujících látek (kyselina askorbová, thioglykolát, thiosíran) do média. Pokud anaerobní prostředí pro kultivaci vytváříme, využíváme tzv. anaerostatu a směsi chemikálií (železný prášek, kyseliny vinná, citronová), která po ovlhčení uvolňuje vodík, který v přítomnosti katalyzátoru (Pt, Pd) reaguje s přítomným vzdušným kyslíkem za jeho vytěsnění a vzniku molekul vody.
Uchování mikroorganizmů
Typ uchovávání volíme podle jeho zamýšlené délky:
- na Petriho misce při 4 °C, krátkodobě, nutno přeočkovávat (např. laktokoky po týdnu, bacily po 2–3 měsících)
- na šikmém agaru při 4 °C, v řádu týdnů; v místnosti či termostatu při 25 °C v řádu dnů
- ve zkumavce v agaru ve vpichu, po dobu několika měsíců
- na porézních materiálech – želatinových discích, kuličkách, dlouhodobě
- pod sterilním minerálním olejem (houby, bakterie)
- lyofilizované (lyofilizace = sublimace vody ve vakuu), méně šetrná než kryoprezervace, všechny mikroorganizmy nelze lyofilizovat, např. houby; dochází ke snížení viability, lyofilizované kultury jsou připravené ihned k odeslání, snadná manipulace
- zmrazené na –70 °C (např. v kultivačním médiu s 15 % glycerolu) po malých objemech v hlubokomrazicím boxu, přežívání měsíce, roky
- boxy s pevným CO2, suchý led (-78 °C), běžné hlubokomrazící boxy
- kryogenní hlubokomrazící boxy (–150 °C)
- kryoprezervace – zamražení kultur ve velmi nízkých teplotách, např. v tekutém dusíku (až –196°C) nebo v jiných plynech (He, Cr, H), uchovávání neomezeně dlouho. Nejvhodnější je postupné ochlazování (kontrolovaná rychlost zamražení: ideálně 1 °C/min. pro snížení osmotické disbalance a proti nevhodnému formování krystalů vody v buňce (amorfní led); některé odolné bakterie snesou rychlejší nebo okamžité zamražení – dle rigidity buňky). Vhodné je použít kryoprotektanty v ochranném médiu – dimethylsulfoxid, glycerol.
Vlastnosti mikroorganizmů ve cvičení
Escherichia coli
(čeleď Enterobacteriaceae): gramnegativní rovné tyčky vyskytující se jednotlivě nebo po dvou. Pohyblivé pomocí peritrichálních bičíků nebo nepohyblivé, mezofilní, fakultativně anaerobní. Běžný komenzál tlustého střeva, pomáhá udržovat rovnováhu mikroflóry, působí proti patogenům střeva, syntetizuje vitaminy A, B, K. Pokud se dostane mimo střevo, může působit jako patogen. Fekálním znečištěním se dostává do vody, kde může přežít řadu týdnů – nejběžnější indikátor fekální kontaminace pitné vody. Slouží jako model genového inženýrství (sekvenace celého genomu), producent různých látek (např. inzulín).
Patogenní kmeny E. coli jsou charakterizovány a identifikovány sérologicky (somatické, kapsulární, bičíkové antigeny) i biochemicky: enterotoxigenní E. coli (ETEC) – cestovatelské průjmy, endemický výskyt v teplých oblastech; enteropatogenní E. coli (EPEC) – průjmy novorozenců, alterace epitelu střeva; enteroinvazivní E. coli (EIEC); enterohemoragická E. coli (EHEC) – způsobuje hemoragie (krvácení do orgánů trávicího traktu).
Serratia marcescens
(čeleď Enterobacteriaceae): gramnegativní rovné tyčky, fakultativně anaerobní, mezofilní, tvorba červeného pigmentu. Výskyt v půdě, vodě, na rostlinných površích, ale i oportunní patogen člověka – častý původce nozokomiálních infekcí močového a dýchacího traktu. Může být součástí zubního povlaku (pigmentace zubu), je původcem růžového povlaku ve vlhkém prostředí koupelen.
Pseudomonas
(čeleď Pseudomonadaceae): gramnegativní rovné nebo nepatrně zakřivené tyčky, schopnost pohybu jedním nebo více polárními bičíky. Optimální kultivační teplota je 25–30 °C, aerobní. Tvorba fenazinových exopigmentů pyocyaninu a fluorescinu (pyoveridinu), které způsobují modrozelené a žluté až žlutozelené zabarvení kultury i kultivačního média. Výskyt v prostředí, ve zkažené potravě (vajíčka, ryby, mléko), častá izolace z klinických vzorků. Významné lidské, zvířecí i rostlinné patogeny, původci nozokomiálních infekcí; faktorem virulence je tvorba biofilmu s vysokým stupněm rezistence na povrchu tkání nebo předmětů díky tvorbě polysacharidu alginátu (P. aeruginosa nebo P. fluorescens), který tvoří matrix biofilmu a chrání buňky vůči působení dezinfekčních látek, protilátek a antibiotik. Akumuluje poly-β-hydroxybutyrát. Díky širokému spektru metabolických drah se podílí na geochemických cyklech, biodegradacích a významně se uplatňuje při bioremediacích (např. degradace toluenu) nebo jako biokontrolní agens.
P. putida – bioremediace; P. fluorescens – produkce fluoresceinu
Kocuria rosea
(čeleď Micrococcaceae): grampozitivní koky uspořádané po dvou, ve čtveřicích či shlucích. Aerobní, mezofilní, tvoří růžové a červené pigmenty. Výskyt v půdě, vodě, prachu, na kůži savců. Rod byl pojmenován na počest významného brněnského mikrobiologa doc. RNDr. Miloše Kocura, CSc.
Micrococcus luteus
(čeleď Micrococcaceae): grampozitivní koky uspořádané po dvou, ve čtveřicích či shlucích, aerobní. Výskyt na pokožce savců, v potravinách, půdě, vzduchu a vodě. Produkce žlutého pigmentu.
Staphylococcus aureus
(čeleď Staphylococcaceae): grampozitivní koky vyskytující se jednotlivě, po dvou nebo v nepravidelných shlucích. Kolonie mohou být bílé nebo nažloutlé. Výskyt na kůži a sliznicích teplokrevných obratlovců, v potravinách a v prostředí. Některé druhy jsou patogenní a produkují toxiny.
Bacillus
(čeleď Bacillaceae): grampozitivní rovné tyčky, často ve dvojici či v řetízcích, pohyblivé, aerobní či fakultativně anaerobní. Výskyt v půdě, vodě, potravinách (rýže). Několik druhů rodu jsou patogeny člověka či hmyzu. Produkce toxinů (otravy z jídla, gastroenteritidy). Tvoří oválné či kulaté endospory, které jsou v buňce uloženy terminálně, subterminálně, paracentrálně či centrálně a které se mohou využívat jako biopesticidy (B. thuringiensis). Tvar, velikost a uložení spory je charakteristický znak pro identifikaci.
- B. cereus – prostředí, způsobuje gastroenteritidy, alimentární intoxikace
- B. subtilis – prostředí, izolován při potravinových otravách
- B. mycoides – prostředí, rhizoidní růst
- B. sphaericus – půda i vodní sedimenty, potraviny
- B. thuringiensis – patogenní pro hmyz, produkce toxinů (parasporální tělísko)
Saccharomyces cerevisiae
patří mezi eukaryotní mikroorganizmy. Mezofilní, fakultativně anaerobní kvasinka. Buňka vejcovitého tvaru je výrazně větší než buňky bakterií. Buněčná stěna neobsahuje peptidoglykan. Výskyt v prostředí a v průmyslových provozech. První osekvenovaný eukaryotický organizmus. Výroba potravin (pivo, víno, pečivo), produkce různých látek (např. inzulín, rekombinantní vakcína HBsAg), modelový organizmus.
Seznam přístrojů, materiálu a mikroorganizmů
Pomůcky a chemikálie
- Bakteriologické plotny s MPA (MEA v případě S. cerevisiae)
- Zkumavky se šikmým agarem MPA (MEA v případě S. cerevisiae)
- Zkumavky s tekutým médiem MPB (MEB v případě S. cerevisiae)
- Očkovací kličky, očkovací jehly, termostat, kahan
Mikroorganizmy
- Escherichia coli CCM 3954
- Pseudomonas putida,
- P. fluorescens CCM 2115T
- Serratia marcescens CCM 303
- Kocuria rosea CCM 839
- Micrococcus luteus CCM 169
- Bacillus cereus CCM 2010
- Staphylococcus aureus SA 812
- Saccharomyces cerevisiae
Postup
Do kultury ani média nesmí vniknout cizí mikroorganizmy ze vzduchu, z pomůcek, vlastní mikroflóry, dodržujeme zásady aseptické práce. Pracujeme co nejrychleji v zavřené místnosti, omytýma rukama a na dezinfikovaném stole, blízko plamene kahanu. Hrdla nádob i zátek před a po práci ožehneme plamenem. Zátky nikdy nepokládáme, ale držíme mezi malíčkem a prsteníčkem (obr. 3). Nádoby s kulturou necháváme otevřené jen po nezbytně dlouhou dobu a s hrdlem poblíž plamene.

Ve cvičení kultivujeme mikroorganizmy staticky, aerobní kultivací na agarech (misky a šikmé agary) a v tekutém médiu ve zkumavkách. Kmeny jsou kultivovány na doporučených médiích v termostatu při optimální teplotě růstu dané kultury. Kultury na Petriho miskách kultivujeme vždy dnem vzhůru z důvodu udržení vlhkosti média a zabránění tvorby kondenzní vody na víčku, která by jinak skapávala na povrch média. Došlo by ke znehodnocení kultury na misce. Médium zároveň pomaleji vysychá.
Ve cvičení každý pracuje samostatně.
Všechny zkumavky i Petriho misky popsat permanentním popisovačem na sklo (druh, datum, označení skupiny, iniciály) vždy před začátkem očkovacích prací.
Každý student očkuje:
- 1 kmen do tekutého média
- 1 kmen na šikmý agar
- dva nebo čtyři různé kmeny na 1 misku do 2 nebo 4 „hádků“
- 1 až 3 kmeny na Petriho misku křížovým roztěrem
- směs dvou kmenů na Petriho misku křížovým roztěrem – cílem je izolace 2 typů kolonií (vhodné je naočkovat směs dvou různě pigmentovaných kmenů či grampozitivní a gramnegativní kulturu)
Očkování kultur na šikmý agar
- Vyžíhat bakteriologickou kličkou a nechat vychladnout.
- Do levé ruky uchopit obě zkumavky se šikmým agarem, malíčkem pravé ruky vytáhnout zátku ze zkumavky s kulturou (obr. 3).
- Hrdlo zkumavky ožehnout
- Sterilní (ožehnutou a vychladlou) kličku vsunout do zkumavky s kulturou, nabrat nárůst do očka kličky. Kličku vytáhnout, ožehnout hrdlo zkumavky i zátku a zkumavku zazátkovat.
- Malíčkem pravé ruky vytáhnout zátku ze sterilní zkumavky s čistým šikmým agarem, ožehnout hrdlo zkumavky a kličkou naočkovat na šikmý agar tzv. hádka.
- Ožehnout hrdlo zkumavky i zátku, uzavřít zkumavku a vyžíhat kličku.
Očkování kultur na agary v Petriho misce do sektorů tzv. hádkem
- Zespodu rozdělit misku popisovačem na sektory a označit.
- Ze zkumavky s kulturou odebrat nárůst na bakteriologickou kličku výše uvedeným postupem.
- Mírně odklopit víčko Petriho misky a nanést kulturu na příslušný sektor agaru tažením kličky, tzv. hádek (obr. 4).
- Přiklopit víčko a vyžíhat kličku.
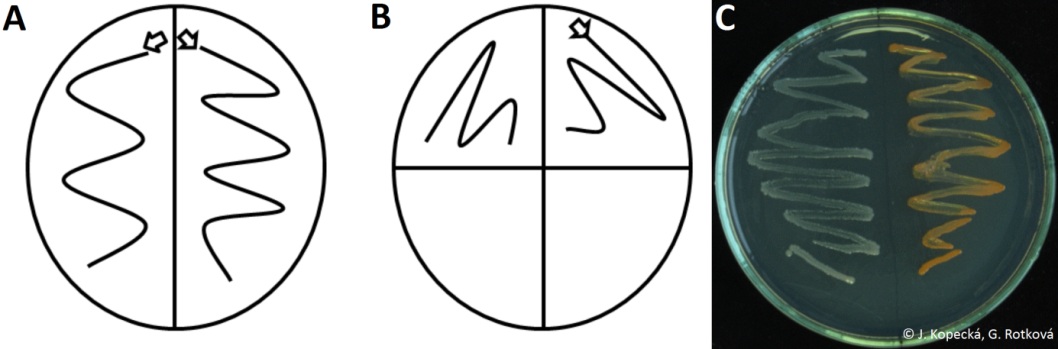
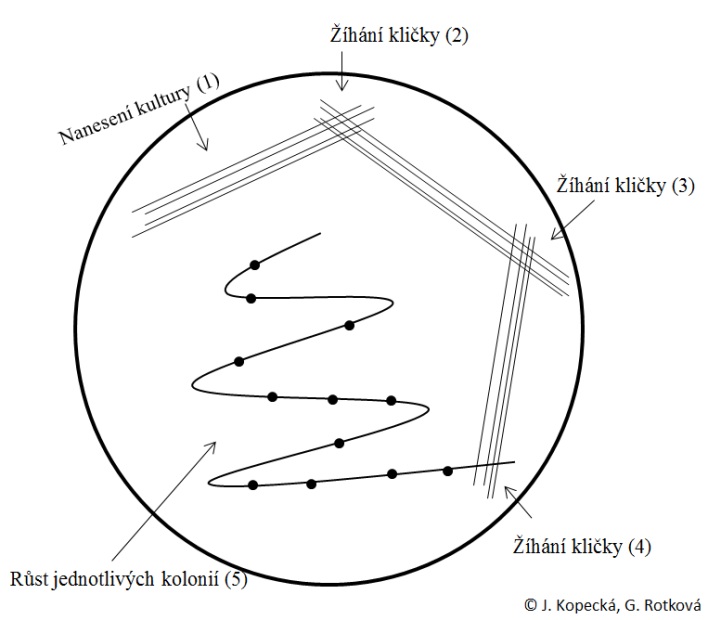
Očkování kultur agary v Petriho misce – křížový roztěr (obr. 5)
- Ze zkumavky s kulturou odebrat nárůst na bakteriologickou kličku výše uvedeným postupem.
- Mírně odklopit víčko Petriho misky a nanést kulturu na agar tažením kličky po agaru v několika pruzích (1).
- Vyžíhat kličku, nechat vychladnout a několika tahy kličkou rozetřít kulturu v koncové části nanesené kultury (2).
- Vyžíhat kličku, nechat vychladnout a několika tahy kličkou rozetřít kulturu v koncové části nanesené kultury (3).
- Vyžíhat kličku, nechat vychladnout a plynulým tahem, tzv. hádkem, rozetřít naředěnou kulturu (4). V místě tzv. hádka by měly vyrůst jednotlivé kolonie (5)
Očkování do tekutého média
- Kulturu odebrat z tuhého média kličkou (z Petriho misek odebrat jednu kolonii).
- Zkumavku s tekutým médiem uchopit do levé ruky, malíkem pravé ruky vytáhnout zátku a ožehnout hrdlo zkumavky.
- Odebraný vzorek rozetřít po stěně zkumavky nad hladinou média a postupně buňky převádět do jeho objemu.
- Ožehnout hrdlo zkumavky i zátku, uzavřít a vyžíhat kličku.
Očkování kultur z tekutého do tekutého média
- Uchopit sterilní pipetu do pravé ruky (skleněnou nebo automatickou), malíkem vytáhnout zátku z baňky/zkumavky, hrdlo ožehnout a pipetou odebrat požadovaný objem kultury. Ožehnout zátku a uzavřít baňku.
- Malíkem pravé ruky vytáhnout zátku z baňky/zkumavky se sterilním tekutým médiem a ožehnout hrdlo.
- Vypustit kulturu z pipety do sterilního média, ožehnout zátku i hrdlo, baňku/zkumavku uzavřít a mírně protřepat.
Očkování z tekutého média na agary v Petriho misce
- Uchopit sterilní pipetu do pravé ruky (skleněnou nebo automatickou), malíkem vytáhnout zátku z baňky nebo zkumavky, hrdlo ožehnout a pipetou odebrat požadovaný objem kultury (obvykle 100 µl). Ožehnout zátku a uzavřít baňku.
- Daný objem vypustit do středu Petriho misky s agarem.
- Sterilní hokejkou (též L kličkou) kulturu rozetřít po povrchu misky, ihned přiklopit víčko misky a chvíli nechat kulturu vsáknout do agaru.
Inkubace
- Inkubace probíhá při 30 či 37 °C po dobu 24–48 hodin.
Zhodnocení cvičení
- Prokázala se sterilita práce při přípravě médií v minulém cvičení?
- Do jakých typů médií a jakým způsobem byly kmeny očkovány?
- Co je účelem křížového roztěru?
- Při jaké teplotě budou kmeny inkubovány?
- Jak odvodíme správné podmínky inkubace?
- Závisí morfologie kolonií na podmínkách kultivace?
Další informace k této problematice najdete v následující literatuře
- Miniatlas mikroorganizmů (http://sci.muni.cz/mikrob/Miniatlas/mikr.htm)
- Greenwood D., Slack R. C. B., Peuthere a kol., Lékařská mikrobiologie. GRADA Publishing, 1999, ISBN 80-7169-365-0.
- Němec M., Matoulková D., Základy obecné mikrobiologie, Masarykova univerzita, Brno, 2015, ISBN 978-80-210-7923-6.
- Sedláček I., Taxonomie prokaryot, Masarykova univerzita, Brno, 2007, ISBN 80-210-4207-9.
Kontrolní otázky
- K čemu slouží kultivace kultury na misce a k čemu kultivace na šikmém agaru?
- Jaké jsou základní fáze růstové křivky? Sledujeme jednu buňku nebo celou populaci?
- Je možno posuzovat čistotu kultury v tekutém médiu? Pokud ne, jak by se při posouzení přítomnosti jediné bakteriální kultury dokázalo?
- Proč se kultury mikroorganizmů přeočkovávají?
- Co ovlivňuje morfologii bakteriální kolonie?
- Poroste fakultativní anaerob za přístupu kyslíku? Pokud ano, proč tomu tak je?
- Jakými prostředky a podmínkami kultivace můžeme vyselektovat určité skupiny bakterií?
- Jak ověříme „čistotu“ kmene kultivací?
- Co znamená a jak se provádí izolace bakteriálního kmene?
- Jaký je princip křížového roztěru?
- Co způsobilo, že na misce křížového roztěru kultura vůbec nevyrostla?
- Co zajišťuje aseptickou práci při přeočkování kultury?
- Co způsobilo, že v poslední části křížového roztěru nevyrůstají izolované bakteriální kolonie, ale „souvislý hádek“?
- K čemu slouží selektivní média?
- Jak rozdělujeme mikroorganizmy podle vztahu ke kyslíku a do jakých skupin podle teplotního optima?
- K čemu slouží očkovací klička a k čemu L-klička?
- Porovnejte kultivaci statickou a kontinuální z hlediska dostupnosti živin a hromadění metabolitů.
- Která fáze růstové křivky a proč se nejvíce hodí pro odečet parametrů růstu kultury?
- Jaký je rozdíl mezi obligátním a fakultativním anaerobem co se týče tolerance ke kyslíku?
- Co je to smíšená bakteriální kultura?
- Co je to čistá bakteriální kultura?
- Jaký je rozdíl mezi termofilem a termotolerantním mezofilem co se týče citlivosti k teplotě?
- Jaké jsou metody očkování mikroorganizmů, které pomůcky pro něj můžeme použít?