Stanovení citlivosti mikroorganizmů k antibiotikům, stanovení koncentrace antibiotik
Cíl cvičení
- Stanovit a porovnat citlivost mikroorganizmů k různým antibiotikům.
- Stanovit koncentraci neznámého vzorku antibiotika.
Úvodní slovo
Antibiotika (ATB) jsou sekundární metabolity mikroorganizmů, jsou přirozeně syntetizovaná pro potlačení růstu konkurenčních organizmů. Poskytují výhodu při soutěži o ekologickou niku a o substrát. V prostředí patří mezi největší producenty ATB vláknité mikroskopické houby, např. Penicillium, Aspergillus, Acremonium („Cephalosporium“), Paecilomyces, a dále vláknité aktinobakterie. Vzhledem ke schopnosti působit na růst mikrobů, včetně patogenů, jsou ATB využívána jako chemoterapeutické látky. Prvním nalezeným ATB byl penicilin produkovaný plísní Penicillium chrysogenum (Fleming 1928), následoval streptomycin produkovaný zástupci rodu Streptomyces. Mezi bakteriální producenty ATB patří právě aktinobakterie; vybraní producenti: Streptomyces griseus (streptomycin), S. kanamyceticus (kanamycin), S. erythaeus (erythromycin), S. venezuelae (chloramfenikol), S. aureofaciens (chlortetracyklin), S. fradiae (neomycin); a ojediněle i zástupci kmene Firmicutes, jako např. Bacillus subtilis (bacitracin), Paenibacillus polymyxa (polymyxin).
Antimikrobiální látky patří spolu s dezinfekčními prostředky mezi chemické metody kontroly mikrobiálního růstu. Mezi antimikrobiální látky patří i antiparazitika, antimykotika, antivirotika, antituberkulotika. V praxi se využívají přirozená či modifikovaná ATB. Podle spektra účinku rozeznáváme úzko- a širokospektrá ATB podávaná lokálně, orálně nebo injekčně. Používají se i jejich kombinace (např. při smíšených infekcích). Antimikrobiální látky jsou používány s ohledem na bakteriální druh, pH, rozpustnost, toxicitu a cenu. Při rozhodování o nejvhodnější kombinaci ATB by měl lékař přihlížet k anamnéze pacienta. Vedlejšími účinky ATB bývá jejich toxická aktivita (ledviny, játra, placenta) a propuknutí sekundární infekce poškozením vlastní mikroflóry. Důležitými kritérii pro zhodnocení účinku antimikrobiální látky je její koncentrace, doba kontaktu a je-li pro bakterii letální (baktericidní) nebo způsobuje pouze přechodnou inhibici růstu (bakteriostatická).
Mechanizmy účinku ATB
Inhibice proteosyntézy konkurenčního kmene brání iniciaci proteosyntézy, interferuje s translací vazbou na ribozom, brání vazbě peptidylové tRNA na peptidylové místo (P-místo), brání elongaci polypeptidu na 30S nebo 50S podjednotce ribozomu, např. aminoglykosidy, makrolidy, tetracykliny, linkosamidy, amfenikoly, kyselina fusidová.
Ovlivnění syntézy DNA a RNA vyvázáním podjednotky DNA gyrázy, brání transkripci vyvázáním RNA polymerázy, interference s bakteriální DNA a RNA, baktericidní, např. chinolony, rifampicin.
Antibiotika pro inhibici propustnosti cytoplazmatické membrány jsou baktericidní, např. polypeptidy, antimykotika polyenového charakteru.
Působení na syntézu buněčné stěny, na syntézu peptidoglykanu, ovlivňuje baktericidně pouze rostoucí buňky inhibicí tvorby vazeb peptidoglykanu, braní pohybu prekurzorů peptidoglykanu, např. β-laktamy, glykopeptidy (penicilin, cefalosporin, vankomycin, teikoplanin, bacitracin, cykloserin, fosfomycin).
Antagonizmus a kompetitivní inhibice, působení na syntézu kyseliny listové, trimetoprim, dapson, izoniazid.
Infekční onemocnění jsou celosvětově zodpovědná za přibližně 40 % všech úmrtí i vzhledem k narůstající rezistenci patogenů vůči ATB. Rezistentní kmeny bakterií mají schopnost nepřijímat (absence receptorů, efluxní systémy), štěpit, inaktivovat (např. β‑laktamáza inaktivuje β-laktamová ATB) a vylučovat ATB, modifikovat cílové struktury (metylace rRNA) anebo modifikovat enzymatickou dráhu.
Rezistence může být primární, která vyplývá z přirozených vlastností a funkcí buňky (chybějící receptor, transportní systém či cílové místo působení ATB), a sekundární, získaná, která je způsobena spontánními změnami v genomu mutacemi či přenosem genetické informace plazmidem či transdukcí. Sekundární rezistenci přispívá nevhodné zacházení s ATB. Rezistentní bakterie jsou krátce přítomny v nízké frekvenci (frekvence výskytu mutantních kmenů pro danou vlastnost je stabilně 10-8), ale vzhledem k horizontálnímu přenosu plazmidů konjugací a rychlému množení buněk s plazmidem (vertikálně = na potomstvo) frekvence rychle roste. K šíření rezistence přispívají i chovatelé zvířat a preventivní podávání ATB zvířatům.
Boj proti šíření bakteriálních rezistencí probíhá v mnoha oblastech: zpřísnění hygienických a epidemiologických opatření, omezení podávání ATB u zvířat pouze na závažné infekce, dohled nad podáváním a užíváním ATB. Důraz se klade i na evidenci a kontrolu nozokomiálních infekcí a informovanost lékařů i nemocných. Podle odhadů jsou ATB podávána často zbytečně nebo chybně (virové infekce, léčba neinfekčních chorob, neracionální střídání řady ATB, předčasné podávání ATB poslední generace, ustupování požadavkům pacientů, předčasné ukončení užívání ATB). Sám Fleming varoval před nesprávným užíváním penicilinu. Postupným zvyšováním jeho koncentrace se mu podařilo získat značně odolné bakterie. Jeho obavy se splnily už v roce 1945, kdy byly pozorovány pneumonie a šoky vyvolané na penicilin rezistentními kmeny Staphylococcus aureus. V roce 1966 pak bylo už 35 % S. aureus plně odolných k meticilinu. V roce 1967 byla zaznamenána i rezistence pneumokoků. V polovině 70. let v Japonsku zjistili, že 62 % streptokoků skupiny A získalo rezistenci na erytromycin. Fluorochinolony zavedené v roce 1980 zabíjely zprvu 95 % na meticilin rezistentních stafylokoků, ale za pouhý rok k nim získalo rezistenci 80 % stafylokoků. V posledním desetiletí se objevily rezistentní kmeny Escherichia coli, klebsiel, enterokoků, Proteus mirabilis, mykobakterií, salmonel i dalších bakterií a jejich výskyt se trvale zvyšuje. V současnosti existují bakteriální kmeny odolné k více ATB zároveň, tzv. multirezistentní kmeny.
Důležitou roli sehrávají průzkumy a monitorování rezistentních kmenů v rámci projektu EARS-Net (Europen Antimicrobial Resistance Surveillance Network), který sbírá, analyzuje a sdílí data. V ČR na projektu spolupracuje mnoho nemocnic a zdravotnických zařízení, které mají vyspělý systém monitorování rezistencí na ATB. Mezi problémové rody v ČR s četnými rezistencemi patří např. rody Escherichia, Salmonela, Pseudomonas, Staphylococcus, Enterococcus, Mycobacterium, některé kmeny jsou navíc multirezistentní. Rezistence závisí do jisté míry na selekčním tlaku ATB, kdy bakterie mobilizuje plazmid s geny pro rezistenci. Funkční operon se vymění za jiný a dochází k předání plazmidu horizontální cestou i mezi různými rody.
V současnosti probíhá výzkum biosyntézy nových, zejména hybridních ATB pomocí genového inženýrství a kombinatoriální biochemie. Alternativou použití antibiotik je fágová terapie s cíleným účinkem na přítomného patogena. Při fágové terapii nedochází k ovlivnění přirozené mikroflóry jako u většiny ATB.
Z hlediska aplikace v humánní nebo veterinární medicíně je důležité určit citlivost mikroorganizmu k aplikované látce, což napomáhá jeho identifikaci. Souhrn testů citlivosti na ATB se nazývá antibiogram. U všech mikrobiologických metod je nutno zachovávat stejnou dobu a teplotu kultivace pro daný mikroorganizmus a testovanou látku. Protože citlivost difúzních metod je závislá především na difúzi testované látky v agarové vrstvě, je nutno při její přípravě dodržet některé podmínky: konstantní hustotu a vlhkost agaru, stejnou tloušťku agaru, přípravu agaru s absolutně rovným povrchem. Pro testování citlivosti k ATB se standardně využívá Mueller‑Hinton agar, který je bohatý na živiny, má nižší obsah ztužovadla a standardní difúzní schopnost. Kromě stanovení citlivosti k ATB se Mueller-Hinton agar využívá pro izolaci rodů Neisseria a Moraxella.
Pro stanovení koncentrace látek, které inhibují nebo stimulují růst mikroorganizmů, se využívají metody zřeďovací, nefelometrické, titrimetrické a difúzní.
Nejnižší koncentrace antimikrobiální látky, při které ještě nepozorujeme bakteriální růst, se nazývá minimální inhibiční koncentrace (MIC) antibiotika. Vyjadřuje množství ATB (g/ml, mg/l), které úplně potlačí růst kmene pěstovaného in vitro. MIC je možné určit pomocí kvantitativní zřeďovací metody, která se provádí ve zkumavce nebo na mikrotitrační destičce. Za citlivý se považuje kmen, jehož MIC je 2-4x menší než koncentrace dosahovaná terapeuticky v krvi. Za rezistentní se považuje kmen, který se množí při koncentraci ATB výrazně vyšší, než je průměrná MIC u kmenů téhož druhu.
Difúzní stanovení citlivosti k ATB (kvalitativní test) se dělí dle způsobu nanášení testované látky. Kapkové metody, kdy se látka kape na povrch tuhého média. Diskové metody využívají disky filtračního papíru, které jsou nasyceny testovanou látkou a kladou se na agarové plotny (rutinní testování citlivosti patogenních mikroorganizmů na ATB). Při komínkové metodě se do agarové vrstvy vtlačují komínky ze skla, porcelánu nebo nerezavějící oceli (ne až na dno, stejně hluboko) a do nich se pipetují roztoky testovaných látek. Jamková metoda využívá jamek vyhloubených korkovrtem přímo do agarové vrstvy, do kterých se pipetují testované látky. Kvantitativní diluční E-test sestává z proužkového nosiče napuštěného klesající koncentrací ATB. Sleduje se projasnění nárůstu ve tvaru hruškovité zóny citlivosti na ATB a hodnota MIC.
Postup stanovení citlivosti k antibiotikům difúzním testem – disková metoda
Stanovení citlivosti se nejčastěji provádí pomocí kvalitativního difúzního testu v agarovém médiu. Inokulum o hustotě 0,5 McF se rovnoměrně rozetře po povrchu agaru a potom se na roztěr aplikují papírové disky napuštěné ATB (komerčně dodávané, napuštěné definovaným množstvím). Důležitou informací je rovněž koncentrace ATB uvedená na každém disku.
Během kultivace difunduje látka z disku horizontálně do okolního agaru v koncentračním gradientu. Účinná látka se projeví vytvořením kruhové, tzv. inhibiční zóny kolem disku. Citlivost mikroorganizmu k testované látce se určí z velikosti inhibiční zóny. Velikost zóny je ovlivněna schopností antimikrobiální látky difundovat agarem a rychlostí růstu mikroorganizmu. Hraniční hodnota rezistence je individuální pro každý mikrobiální druh a dané ATB. Správnost testu je kontrolována za pomoci standardních bakteriálních kmenů. Za dodržení přesných podmínek, tzn. kvality agaru, pH, koncentrace iontů, velikosti inokula jsou průměry inhibičních zón srovnatelné s hodnotami MIC (semikvantitativní metoda).
Stanovení koncentrace ATB
Pro stanovení koncentrace látky inhibující růst bakteriálního kmene můžeme využít difúzní jamkovou metodu. Z kalibrační přímky se stanoví neznámá koncentrace vzorků ATB. Hodnoty pro sestavení kalibrační přímky vychází ze známé velikosti zón měřených na několika miskách se známou koncentrací testovaného ATB. Zóny se vytváří kolem 4 jamek, do kterých byl pipetován roztok ATB o známé koncentraci. Z hodnot průměrů inhibičních zón se standardními roztoky se sestrojí kalibrační přímka (závislost průměru zóny v mm na logaritmu koncentrace). Výhodou jamkové metody je, že nemusí být dodržovány sterilní podmínky při práci s testovanou látkou, difúze účinné látky není podstatně ovlivňována ostatními látkami a metoda je dostatečně rychlá a citlivá. Nevýhodou je pracná příprava jamek a nebezpečí přelití testované látky při manipulaci s miskami.
Seznam přístrojů, materiálu a mikroorganizmů
Pomůcky a chemikálie
- Petriho misky s Mueller-Hintonovým agarem
- L-klička, pinzeta, korkovrty, skalpely
- Antimikrobiální disky, standardy a testované vzorky oxacilinu
- Automatická pipeta, sterilní špičky, pravítko
- ATB: vankomycin - 30 µg (glykopeptidy), rifampicin - 5 µg (ansamyciny), chloramfenikol - 30 µg (amfenikoly), cefalotin - 30 µg (cefalosporiny I. generace), nitrofurantoin - 100 µg, oxacilin - 1 µg (isoxazolylpeniciliny, penicilináza rezistentní), tetracyklin - 30 µg (cykliny), ko-trimoxazol - 25 µg (sulfonamidy s potencovaným antimikrobním účinkem), penicilin - 10 MJ (beta‑laktamy, dipeptidy)
MJ (mezinárodní jednotka; IU = International Unit) je měrná jednotka pro množství účinné látky, založená nikoli na hmotnosti, nýbrž na naměřeném biologickém působení nebo účinku
Mikroorganizmy
- Micrococcus luteus CCM 169
- Staphylococcus saprophyticus subsp. saprophyticus CCM 2354
- Bacillus cereus CCM 2010
- Proteus vulgaris CCM 1799
- Escherichia coli CCM 3954
- Staphylococcus aureus NCTC 8511
- Providencia rettgeri CCM 5618
Postup
Stanovení citlivosti mikroorganizmu k ATB – disková difúzní metoda
- Na povrch Mueller-Hinton agaru pipetovat 0,2 ml bujónové kultury a rozetřít sterilní L-kličkou.
- Na misku sterilně pomocí jehly rozložit 4 testovací disky s ATB v dostatečné vzdálenosti od sebe a od kraje misky.
- Inkubovat 24-36 hodin při 37 °C.
Hodnocení
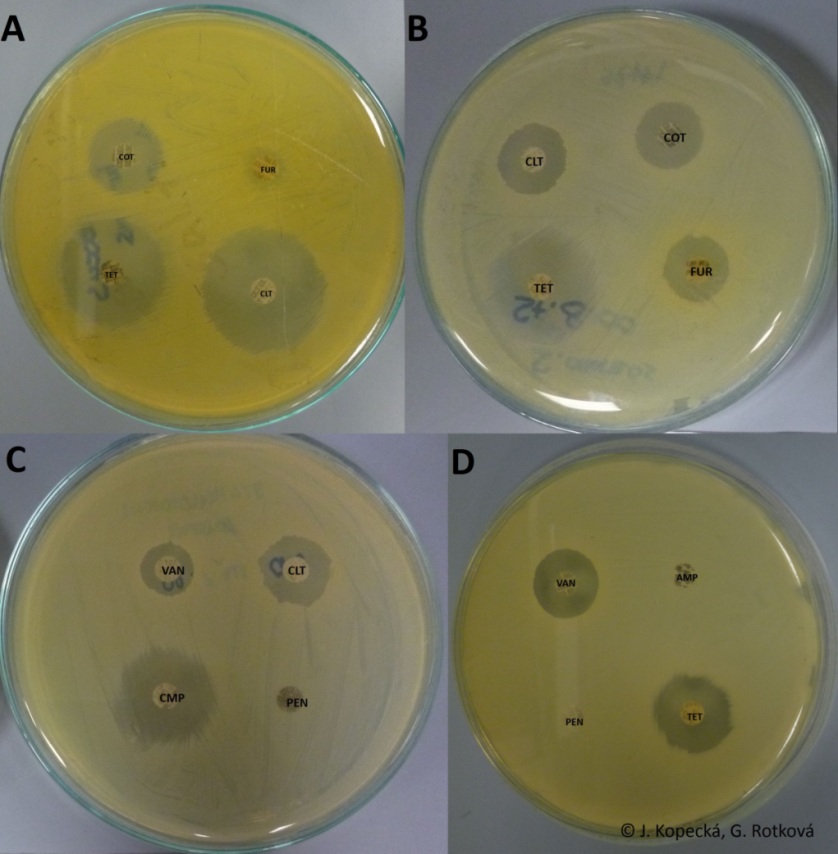
- Pozorovat růst mikroorganizmu kolem ATB disků (obr. 32).
- Měřit velikost inhibičních zón jako délku úseček průměrů zóny měřených ve dvou na sebe kolmých směrech (velikost disku je v hodnocení započítána).
- Vypočítat aritmetický průměr a stanovit citlivost: necitlivý mikroorganizmus (inhibiční zóna do 11 mm), citlivý mikroorganizmus (inhibiční zóna 11-17 mm), velmi citlivý mikroorganizmus (inhibiční zóna nad 17 mm).
Stanovení koncentrace oxacilinu difúzní jamkovou metodou
- Rozvařit Mueller-Hinton agar (15 ml ve zkumavkách) a temperovat na 45 °C.
- Do zkumavek očkovat 0,5 ml inokula S. aureus NCTC 8511.
- Obsah zkumavek promíchat, vylít do sterilních misek a nechat utuhnout na rovné podložce.
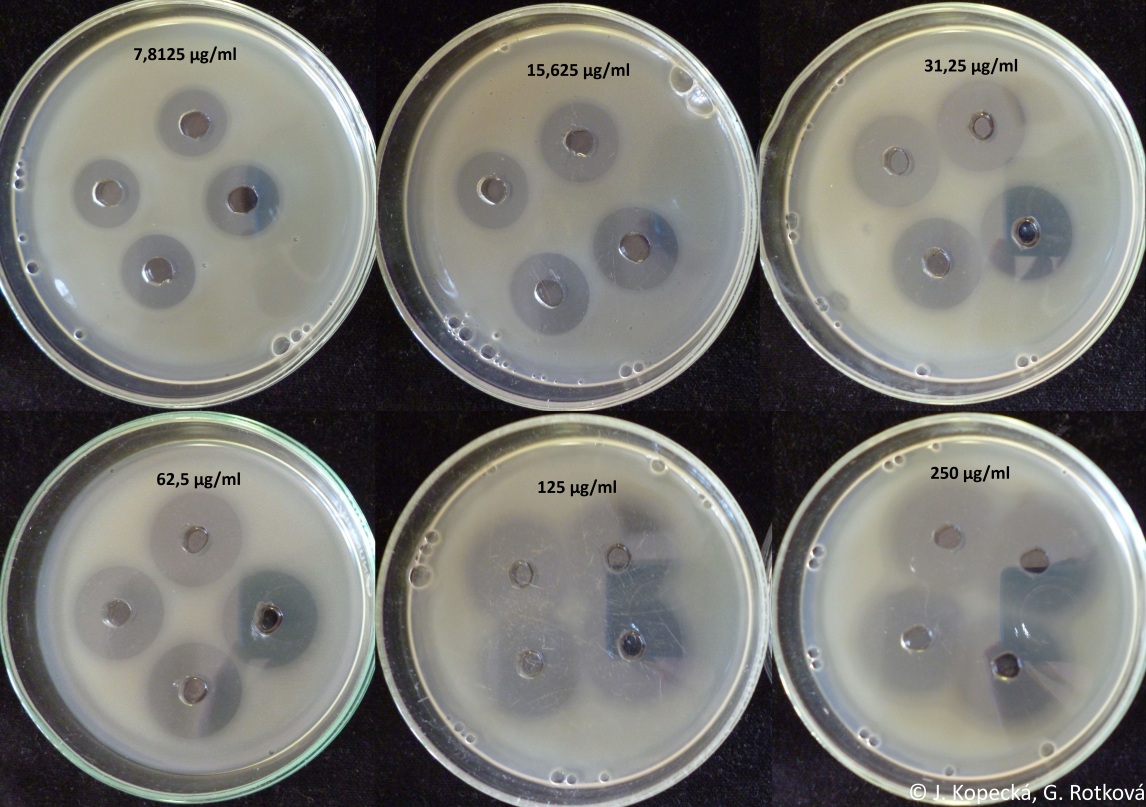
- Připravit standardní řadu ředění oxacilinu, ředit v destilované vodě na koncentrace: 250; 125; 62,5; 31,25; 15,625; 7,81 µg/ml.
- Po utuhnutí agaru vyhloubit korkovrtem a skalpelem na miskách 4 jamky; korkovrt a skalpel sterilizovat ožehnutím po namočení v etanolu. Vyhloubené kousky agaru odkládat do Petriho misky (k likvidaci, obsahují S. aureus). Korkovrt a skalpel je nutné po skončení práce sterilizovat.
- Misky popsat, na 1 misce je vždy 1 standardní koncentrace nebo 1 testovaný vzorek.
- Do každé jamky pipetovat 40 µl roztoku ATB, vždy roztok jedné koncentrace na misku. Je třeba pipetovat i přemisťovat misky opatrně, aby roztoky nepřetékaly přes okraje jamek.
- Inkubovat 24 hodin při 37 °C.
Hodnocení
- Změřit průměry zón ve dvou na sebe kolmých směrech.
- Pro každou zónu vypočítat průměrnou hodnotu, ze 4 zón na misce vypočítat průměrnou hodnotu pro danou koncentraci.
- Z hodnot standardních roztoků (obr. 33) sestrojit kalibrační přímku v MS Excel (závislost průměru zóny v mm na logaritmu koncentrace oxacilinu).
- Z kalibrační přímky (rovnice regrese) stanovit koncentraci neznámých vzorků (µg/ml).
- V protokolu bude uvedeno označení vzorku a jeho koncentrace.
Stanovení antagonistů - přirozených producentů antibiotik
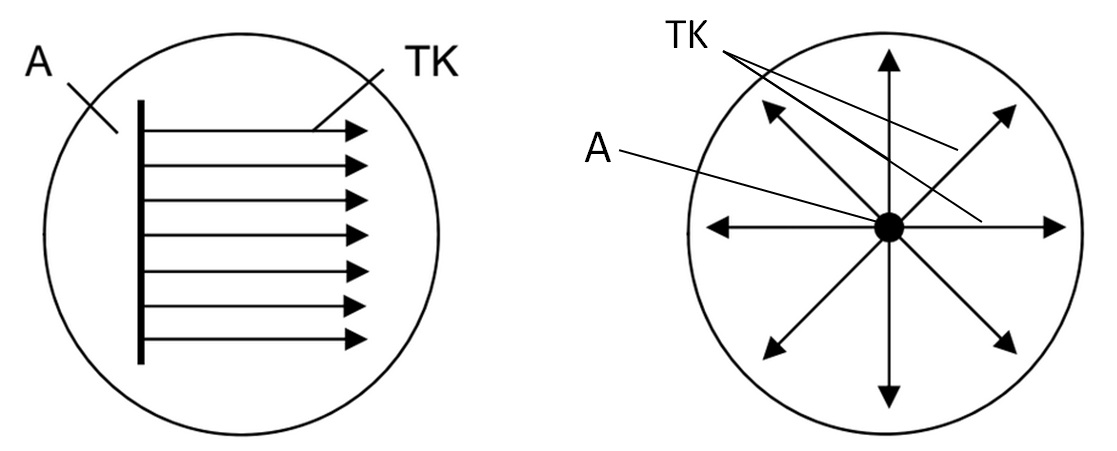
- Na povrch agarové plotny s Mueller-Hinton agarem očkovat v jednom pruhu pravděpodobného producenta antimikrobiálních látek (Streptomyces, B. subtilis, P. polymyxa nebo S. marcescens), viz. obr. 34.
- Kolmo k producentovi očkovat v pruzích testované kmeny bakterií.
- Inkubovat 24-36 hodin při 37 °C.
- Vyhodnotit, zda došlo k inhibici růstu testovaných kmenů bakterií.
Zhodnocení cvičení
- Porovnat citlivost mikroorganizmů k různým ATB, je citlivost různých druhů k jednomu ATB stejná?
- Je stejný účinek jednoho ATB na různé mikroorganizmy?
- Podařilo se sestrojit kalibrační přímku a určit koncentraci neznámého vzorku antibiotika?
Další informace k této problematice najdete v následující literatuře
- Greenwood D., Slack R. C. B., Peuthere a kol., Lékařská mikrobiologie. GRADA Publishing, 1999, ISBN 80-7169-365-0.
- Votava M., Kultivační půdy v lékařské mikrobiologii. Nakladatelství Hortus, Brno, 2000, ISBN 80-238-5058-X.
- Určování citlivosti a rezistence bakteriální kultury k antibakteriálním látkám (zdroj: http://fvl2.vfu.cz/sekce_ustavy/mikrobiologie/obrazova_priloha/mikrob/6.html; 2. 3. 2016)
- Nová látka klíčem ke stovkám antibiotik (zdroj: http://www.gate2biotech.cz/nova-latka-klicem-ke-stovkam-antibiotik/; 2. 3. 2016)
- Nouza K., Nouza M., Antibiotika – hrozí konec éry? Medicína 3, VI, 1999. (zdroj: http://www.zdrava-rodina.cz/med/med399/med399_42.html)
- Eropean Antimicrobial Resistance Surveillance Network (http://ecdc.europa.eu/en/activities/ surveillance/EARS-Net/Pages/index.aspx, 3. 3. 2016)
Kontrolní otázky
- Jaké jsou mechanizmy rezistence bakterií na antibiotika?
- Je antibiotikum produkt primárního metabolizmu? K čemu je bakteriální buňce v prostředí prospěšné?
- Vysvětlete pojem inhibiční zóna.
- Čím se liší antibiotikum od chemoterapeutika?
- K čemu se používá disková difúzní metoda a jaký je její postup?
- Jak se nazývá médium používané pro testování citlivosti na ATB?
- Proč se při stanovení koncentrace antibiotika připravuje ředící řada tohoto antibiotika?
- Co je to MIC?