11 Lokalizace vazeb
V předcházejícím textu byly probrány vazby lokalizované (tj. umístěné jen mezi dva sousední atomy, např. \(\ce{H–Cl}\)). U uhlovodíků s konjugovanými dvojnými vazbami se však setkáváme s tím, že elektrony \(\pi\) vazby mohou být rozprostřeny mezi více atomů (říkáme, že jsou delokalizovány). Vznik delokalizovaných vazeb bude probrán spolu s jejich vlastnostmi přibližně o tři strany dále. Nyní si připomeneme různé možnosti rozmístění dvojných vazeb v molekulách organických látek.
11.1 Způsoby rozmístění dvojných vazeb v molekulách organických látek
 |
dvojná vazba izolovaná |
 |
dvojné vazby kumulované |
 |
dvojné vazby konjugované U těchto vazeb nastává delokalizace. |
Sloučeniny s rozsáhlým konjugovaným systémem dvojných vazeb bývají často barevné, mnohé z nich patří mezi přírodní látky (např. barviva izolovaná z mrkve nebo rajčat). Na následujících stranách je uvedeno několik příkladů barevných organických látek. Všem je společný rozsáhlý konjugovaný systém dvojných vazeb.
Karotenoidy jsou zabarveny od žluté přes oranžovou až po červenou. Patří k nim např. karoteny a lykopen. V mrkvi jsou obsaženy tři karoteny, které se od sebe liší pouze strukturním uspořádáním konců řetězce. Nejhojnějším karotenem je \(\boldsymbol{\beta}\)-karoten:
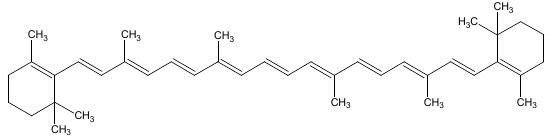
Lykopen je červené barvivo rajských jablíček:

Příklady synteticky připravených barevných organických látek s konjugovaným systémem dvojných vazeb:
| prostředí | struktura | zbarvení |
|---|---|---|
| kyselé a neutrální |  |
bezbarvá forma (3 až 4 dvojné vazby v konjugaci) |
| alkalické |  |
fialová forma (11 dvojných vazeb v konjugaci) |
| prostředí | struktura | zbarvení |
|---|---|---|
| kyselé a neutrální |  |
červená forma |
| alkalické |  |
oranžová forma |
11.2 Teorie delokalizace, delokalizované vazby
Ke vzniku delokalizovaných vazeb dochází u látek s konjugovanými dvojnými vazbami. Zde si vznik delokalizovaných vazeb vysvětlíme na látkách benzen a buta-1,3-dien.
Rozbor vazeb v molekule benzenu
Starší zápis vzorce benzenu je  . Pokud by struktura benzenu přesně odpovídala tomuto vzorci, musely by tři vazby mezi atomy uhlíku mít vlastnosti vazby jednoduché a zbývající tři pak vlastnosti vazby dvojné. To by se projevilo např. na délkách vazeb.
. Pokud by struktura benzenu přesně odpovídala tomuto vzorci, musely by tři vazby mezi atomy uhlíku mít vlastnosti vazby jednoduché a zbývající tři pak vlastnosti vazby dvojné. To by se projevilo např. na délkách vazeb.
Připomeňme si, že délka vazby mezi atomy uhlíku v organických sloučeninách závisí na násobnosti vazby (s rostoucí násobností vazby meziatomová vzdálenost neboli vazebná délka klesá.
Tvar molekuly benzenu by v takovém případě musel být přibližně následující (čísla udávají délku vazby v pikometrech):

Experimentálně však bylo zjištěno, že všech šest vazeb mezi atomy uhlíku v molekule benzenu má stejnou délku (140 pm). Z toho plyne, že zápis  strukturu benzenu nevystihuje správně. Lepší popis rozložení vazeb v molekule benzenu umožňuje tzv. teorie delokalizace.
strukturu benzenu nevystihuje správně. Lepší popis rozložení vazeb v molekule benzenu umožňuje tzv. teorie delokalizace.
Vysvětlení vazeb v molekule benzenu pomocí teorie delokalizace
V molekule benzenu jsou mezi atomy uhlíku jednak lokalizované σ-vazby tvořené hybridními atomovými orbitaly \(\ce{\mathbf{sp^2}}\) (na Obr. 11-1 značeny bíle), jednak \(\pi\)-vazby tvořené elektrony obsaženými v orbitalech \(\MR{\bf{p_{z}}}\) (na Obr. 11-1 značeny šedě) kolmých na rovinu benzenového jádra. Orbitaly \(\MR{\bf{p_{z}}}\) se neúčastní hybridizace. Mezi orbitaly \(\MR{\bf{p_{z}}}\) dochází k bočnému překryvu (symetricky na obě strany - Obr. 11-1b) a tím vznikají delokalizované \(\pi\)-vazby (Obr. 11-1c). Situace je znázorněna na třech následujících částech Obr. 11-1:
 |
a. Rozmístění překrývajících se \(\ce{sp^2}\) HAO tvořících \(\sigma\)-vazby (bíle) v molekule benzenu a orbitalů \(\MR{\bf{p_{z}}}\) (šedě), jejichž bočným překryvem (obrázek b) vzniká systém delokalizovaných \(\pi\)-vazeb. |
 |
b. Vyznačení bočných překryvů orbitalů \(\MR{\bf{p_{z}}}\) vedoucích ke vzniku \(\pi\)-elektronového kruhu (přerušovaná čára). |
 |
c.
Výsledné rozložení vazebných elektronů v molekule benzenu: \(\sigma\)-elektrony: bíle. \(\pi\)-elektrony: šedě. Atomy vodíku nejsou znázorněny. Obrázek znázorňuje, že \(\pi\)-vazby jsou rozprostřeny rovnoměrně po celém kruhu benzenu. Říkáme, že jsou delokalizované. Vzorec benzenu se podle teorie delokalizace zapisuje s kruhem:  . . |
Atomy vodíku nejsou znázorněny.
K delokalizaci \(\pi\)-vazeb dochází i u lineárních molekul s konjugovaným systémem dvojných vazeb; jako příklad si uvedeme buta-1,3-dien (Obr. 11-2 a Obr. 11-3).
| a. | b. |
 |
 |
| Obvyklý zápis (neodpovídá skutečnosti). | Zápis lépe vystihující skutečnost (energie i délky všech vazeb mezi atomy uhlíku jsou v molekule buta-1,3-dienu přibližně stejné). |
 |
a. Rozmístění překrývajících se \(\ce{sp^2}\) HAO tvořících \(\sigma\)-vazby (bíle) v molekule buta-1,3-dienu a orbitalů \(\ce{p_{z}}\) (šedě), jejichž bočným překryvem (obrázek b) vzniká systém delokalizovaných \(\pi\)-vazeb. |
 |
b. Vyznačení bočných překryvů \(\ce{p_{z}}\) orbitalů vedoucích ke vzniku dvou nad sebou umístěných \(\pi\)-elektronových křivek (přerušovaná čára). |
 |
c. Výsledné rozložení vazebných elektronů v molekule buta-1,3-dienu: \(\sigma\)-elektrony: bíle. \(\pi\)-elektrony: šedě. Z obrázku je zřejmé, že \(\pi\)-vazby jsou rozprostřeny rovnoměrně po celé délce molekuly. Říkáme, že jsou delokalizované. U nearomatických systémů se speciální způsob zápisu delokalizovaných vazeb (obvyklý u aromatických látek) nepoužívá. |
Atomy vodíku nejsou znázorněny.
11.3 Teorie rezonance
Teorie rezonance (je starší než teorie delokalizace a dnes se používá spíše výjimečně) vysvětluje vlastnosti molekul obsahujících konjugovaný systém dvojných vazeb pomocí tzv. rezonančních struktur. Jako názorný příklad uvedeme vzorce rezonančních struktur benzenu (Obr. 11-4).

Teorie rezonance předpokládá, že molekula střídavě existuje ve všech rezonančních stavech. Ty se tak rychle vzájemně přeměňují jeden na druhý, že měřením lze zachytit jen střední (průměrnou) strukturu. Tím tato teorie vysvětluje, proč délka vazeb mezi uhlíkovými atomy v molekule benzenu je experimentálně naměřena menší než u jednoduchých, ale větší než u dvojných vazeb.
Protože stálé používání všech rezonančních vzorců by bylo těžkopádné, píše se obvykle jen jeden z nich. Teoreticky je lhostejno, který z rezonančních vzorců se bude v zápisech používat, ale praxe se ustálila na používání jen 1-2 rezonančních vzorců pro každou látku. Např. pro benzen jsou to vzorce  a
a  . Je však nutno mít na paměti, že žádná jednotlivá rezonanční struktura nevystihuje skutečnou strukturu molekuly správně.
. Je však nutno mít na paměti, že žádná jednotlivá rezonanční struktura nevystihuje skutečnou strukturu molekuly správně.