8 Periodický zákon, periodická tabulka, periodicita chemických a fyzikálních vlastností prvků
8.1 Periodický zákon a periodická tabulka
8.1.1 Pohled do historie
Pro systematizaci chemických prvků byla v minulosti postupně navržena různá uspořádání, včetně uspořádání prvků na plášti válce (Alexandre-Emile Béguyer de Chancourtois, 1862, Obr. 8-1).
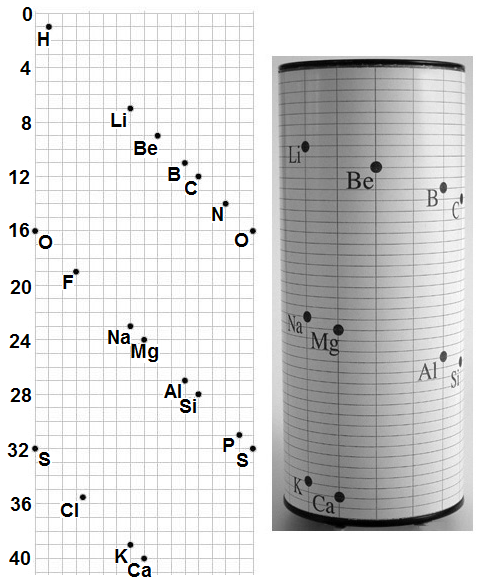
Vhodné uspořádání prvků do „tabulky“ hledalo hodně vědců, ale největší zásluhu na vytvoření periodické soustavy prvků v dnešní podobě měly současné nezávislé práce D. I. Mendělejeva a L. Meyera, přičemž D. I. Mendělejev dospěl k širšímu zobecnění a lepší formulaci periodického zákona.
D. I. Mendělejev seřadil dosud známé prvky na základě jejich vzrůstající atomové hmotnosti. Ze vzniklé řady sestavil roku 1869 tabulku, ve které prvky podobných vlastností byly umístěny vedle sebe (Obr. 8-2). V tabulce se tak odráží periodicita fyzikálních a chemických vlastností prvků a jejich sloučenin. Na základě zřejmých mezer předpověděl existenci některých prvků, v té době neznámých. Např. germanium, které Mendělejev pojmenoval eka-silicium (podle slova eka – vedle, ze sanskrtu), bylo jedním z takto předpovězených prvků – v původním periodickém systému prvků se nacházelo v mezeře vedle křemíku. Dnes se prvky v periodické tabulce řadí ne podle rostoucí atomové hmotnosti, ale podle rostoucího protonového čísla.

8.1.2 Dnešní formulace periodického zákona
Dnešní periodická tabulka prvků je grafickým vyjádřením periodického zákona, jehož původní (Mendělejevovo) znění bylo:
Fyzikální a chemické vlastnosti prvků jsou periodicky závislé na atomové hmotnosti prvků.
Po objasnění struktury elektronového obalu a významu protonového čísla byla formulace periodického zákona pozměněna na znění používané dnes:
Fyzikální a chemické vlastnosti prvků jsou periodickou funkcí jejich protonového čísla.


Mendělejevovo a dnešní uspořádání periodického sytému se liší (kromě nově objevených prvků) ve vzájemném prohození tří dvojic prvků:
- Co a Ni,
- Ar a K,
- Th a Pa.
Mendělejev si byl vědom pouze jedné výjimky, kterou byla vzájemná poloha telluru a jodu. Tyto prvky umístil tak, jak jsou řazeny dnes, přestože to odporovalo jeho vlastní formulaci periodického zákona.
Na periodické soustavě prvků je pozoruhodné, že vznikla již na konci 19. století, tedy v době, kdy nebyla známa elektronová struktura atomu. Avšak mezi elektronovou konfigurací tzv. valenční sféry a uspořádáním prvků v periodické soustavě prvků je přímý vztah.
Například: \(\ce{_{16}S}:\underbrace{\mathrm 1s^22s^22p^6}_{\begin{array}{c}\text{[Ne]}\\ \textbf{core}\end{array}}\underbrace{\mathrm 3s^23p^4}_{\begin{array}{l}\\ \textbf{valenční sféra}\end{array}}\)
8.1.3 Členění periodické soustavy prvků (periodické tabulky)
Konkrétní podoba periodické tabulky prošla mnohaletým vývojem. Současné nejpoužívanější uspořádání periodické tabulky znázorňuje Obr. 8-5:

Prvky jsou v nejpoužívanější tabulce uspořádány do sedmi řad nazývaných periody a osmnácti sloupců nazývaných skupiny. Aby tabulka nebyla příliš dlouhá, vyčleňuje se z 6. periody 14 prvků následujících za lanthanem (tzv. lanthanoidy) a ze 7. periody 14 prvků následujících za aktiniem (tzv. aktinoidy) na zvláštní řádky, které se připojují do dolní části periodické tabulky. V tabulce je toto vyčlenění vhodným způsobem naznačeno (např. tučnou nebo dvojitou linkou za lanthanem a aktiniem).
Kromě číselného označení existují také slovní názvy period, které jsou uvedeny v posledním sloupci v následujícím přehledu:

Ve skupinách (tj. svislých sloupcích) jsou pod sebou prvky s analogickou konfigurací valenční sféry. Celkem je 18 skupin. Označení skupin dříve bývalo I-VIII s přidáním písmene A nebo B. Existovaly však odlišné systémy dělení na A- a B- prvky, dnes se proto na doporučení organizace IUPAC (International Union of Pure and Applied Chemistry) skupiny označují arabskými číslicemi 1-18 (zleva doprava).
V Obr. 8-6 jsou schematicky vyznačeny s-, p-, d- a f-prvky (resp. oblasti, kde jsou tyto prvky v periodické tabulce).
Prvky, u nichž se jako poslední obsazuje orbital ns, se nazývají s-prvky,
prvky, u nichž se jako poslední obsazuje orbital np, se nazývají p-prvky,
prvky, u nichž se jako poslední obsazuje orbital (n – 1)d, se nazývají d-prvky,
prvky, u nichž se jako poslední obsazuje orbital (n – 2)f, se nazývají f-prvky.
Písmeno n před příslušnými orbitaly značí číslo periody, ve které je prvek umístěn (hodnoty 1-7). Hodnota n odpovídá hlavnímu kvantovému číslu.
Prvky označené jako s- a p-prvky se souhrnně označují nepřechodné prvky, d-prvky jsou tzv. přechodné prvky a f-prvky jsou tzv. vnitřně přechodné prvky (Obr. 8-6).

| Prvky | Valenční orbitaly |
|---|---|
| s | \(\mathrm{n{\bf s}^{1-2}}\) |
| p | \(\mathrm{ns^2n{\bf p}^{1-6},\ \text{resp.}\ ns^2(n-1)d^{10}n{\bf p}^{1-6}, resp. ns^2(n-2)f^{14}(n-1)d^{10}n{\bf p}^{1-6}}\) |
| d | \(\mathrm{ns^2(n-1){\bf d}^{1-10},\ \text{resp.}\ ns^2(n-2)f^{14}(n-1){\bf d}^{1-10}}\) |
| f | \(\mathrm{ns^2(n-2){\bf f}^{1-14}}\) |
Mezi chemiky se pro některé skupiny prvků vžily speciální názvy (Obr. 8-7).

8.2 Periodicita chemických a fyzikálních vlastností prvků
Mezi strukturou elektronového obalu a chemickými a fyzikálními vlastnostmi prvků je řada souvislostí, protože podobné chemické chování je dáno podobným uspořádáním vnější (valenční) sféry elektronového obalu.
8.2.1 Příklady periodicity chemických vlastností prvků v jednotlivých skupinách
Podobnost v 1. skupině
Všem těmto prvkům (alkalické kovy) je společná snaha úplně vyprázdnit svoji valenční sféru odštěpením jednoho valenčního elektronu (snaží se úplně vyprázdnit svůj s-orbital, pravidla pro stabilní konfiguraci viz Stabilní elektronová konfigurace iontů). Proto snadno vytvářejí jednomocné kationty.

Všechno to jsou kovy s nízkou hustotou, prudce reagující s vodou za vzniku hydroxidu a uvolnění vodíku:
\begin{array}{ccccccc} \ce{H2O} & + & \ce{Li} & \ce{->} & \ce{LiOH} & + & \ce{1/2H2} \\ \ce{H2O} & + & \ce{Na} & \ce{->} & \ce{NaOH} & + & \ce{1/2H2} \\ \ce{H2O} & + & \ce{K} & \ce{->} & \ce{KOH} & + & \ce{1/2H2} \\ \ce{H2O} & + & \ce{Rb} & \ce{->} & \ce{RbOH} & + & \ce{1/2H2} \\ \ce{H2O} & + & \ce{Cs} & \ce{->} & \ce{CsOH} & + & \ce{1/2H2} \\ \ce{H2O} & + & \ce{Fr} & \ce{->} & \ce{FrOH} & + & \ce{1/2H2} \end{array}Podobnost v 17. skupině (halogeny)
Všem těmto prvkům je společná snaha úplně zaplnit svoji valenční sféru tím, že získají jeden elektron (snaží se úplně zaplnit svoje valenční p-orbitaly) a změnit se tím na jednomocný anion (\(\ce{F-, Cl-, Br-, I-, At-}\)). Všechny halogeny tvoří dvojatomové molekuly.

Podobnost ve 14. skupině
Uhlík, křemík a germanium tvoří sloučeniny s vodíkem, jsou v nich čtyřvazné a mají schopnost se řetězit, jak dokládá následující přehled:

Podobnost v 16. skupině
Kyslík, síra a selen tvoří analogické sloučeniny s analogickými funkčními skupinami, jak dokládá následující přehled:
| Nejčastější oxidační číslo –II | Tvoří analogické funkční skupiny |
|---|---|
| \begin{array}{rlr} \ce{O}: & \ce{[He] 2s^2 2p^4} & \ce{O^{-II}} \\ \ce{S}: & \ce{[Ne] 3s^2 3p^4} & \ce{S^{-II}} \\ \ce{Se}: & \ce{[Ar] 4s^2 3d^{10} 4p^4} & \ce{O^{-II}} \end{array} | \begin{array}{llll} =\ce{O} & \ce{-O-H} & \gt \ce{C=O} & \ce{-O-O -} \\ =\ce{S} & \ce{-S-H} & \gt \ce{C=S} & \ce{-S-S -} \\ =\ce{Se} & \ce{-Se-H} & \gt \ce{C=Se} & \ce{-Se-Se -} \\ \end{array} |
8.2.2 Primární a sekundární periodicita
Rozlišujeme dva druhy periodicity vlastností prvků:
- primární – odvozená od vzácných plynů (\(\ce{\bf He, Ne, Ar, Kr, Xe, Rn}\)) – mají úplně zaplněné s- a p- valenční orbitaly a tvoří tzv. elektronový oktet \(\ce{ns^2 np^6}\) (viz Obr. 8-8)
- sekundární – odvozená od:
Elektronový oktet: \(\ce{He, Ne, Ar, Kr, Xe, Rn}\)

Elektronová osmnáctka: \(\ce{Ni, Pd, Pt}\)

Elektronová dvacítka: \(\ce{Zn, Cd, Hg}\)
| elektronová konfigurace: | [vzácný plyn] | \begin{array}{c}\mathrm{(n-1)s^2}\\2\\\BUDA\end{array} | \begin{array}{c}\phantom{+}\\+\\\phantom{+}\end{array} | \begin{array}{c}\mathrm{(n-1)p^6}\\6\\\BUDA\BUDA\BUDA\end{array} | \begin{array}{c}\phantom{+}\\+\\\phantom{+}\end{array} | \begin{array}{c}\mathrm{ns^2}\\2\\\BUDA\end{array} | \begin{array}{c}\phantom{+}\\+\\\phantom{+}\end{array} | \begin{array}{c}\mathrm{(n-1)d^{10}}\\10\\\BUDA\BUDA\BUDA\BUDA\BUDA\end{array} | \begin{array}{c}\phantom{d^8}\\=20\end{array} |
|---|---|---|---|---|---|---|---|---|---|
| Například: | |||||||||
| \(\ce{Zn:}\) | \(\ce{[Ne]}\) | \begin{array}{c}\mathrm{3s^2}\\\BUDA\end{array} | \begin{array}{c}\mathrm{3p^6}\\\BUDA\BUDA\BUDA\end{array} | \begin{array}{c}\mathrm{4s^2}\\\BUDA\end{array} | \begin{array}{c}\mathrm{3d^{10}}\\\BUDA\BUDA\BUDA\BUDA\BUDA\end{array} |
Současný vliv stabilních elektronových konfigurací
Příklady:
-
prvek obvyklé oxidační číslo konfigurace iontu slovní označení konfigurace \(\ce{Br}\): \(\ce{Br^{-I}}\) \(\ce{[Kr]}\) elektronový oktet \(\ce{Br^{V}}\) \(\ce{[Zn]}\) elektronová dvacítka \(\ce{Br^{VII}}\) \(\ce{[Ni]}\) elektronová osmnáctka
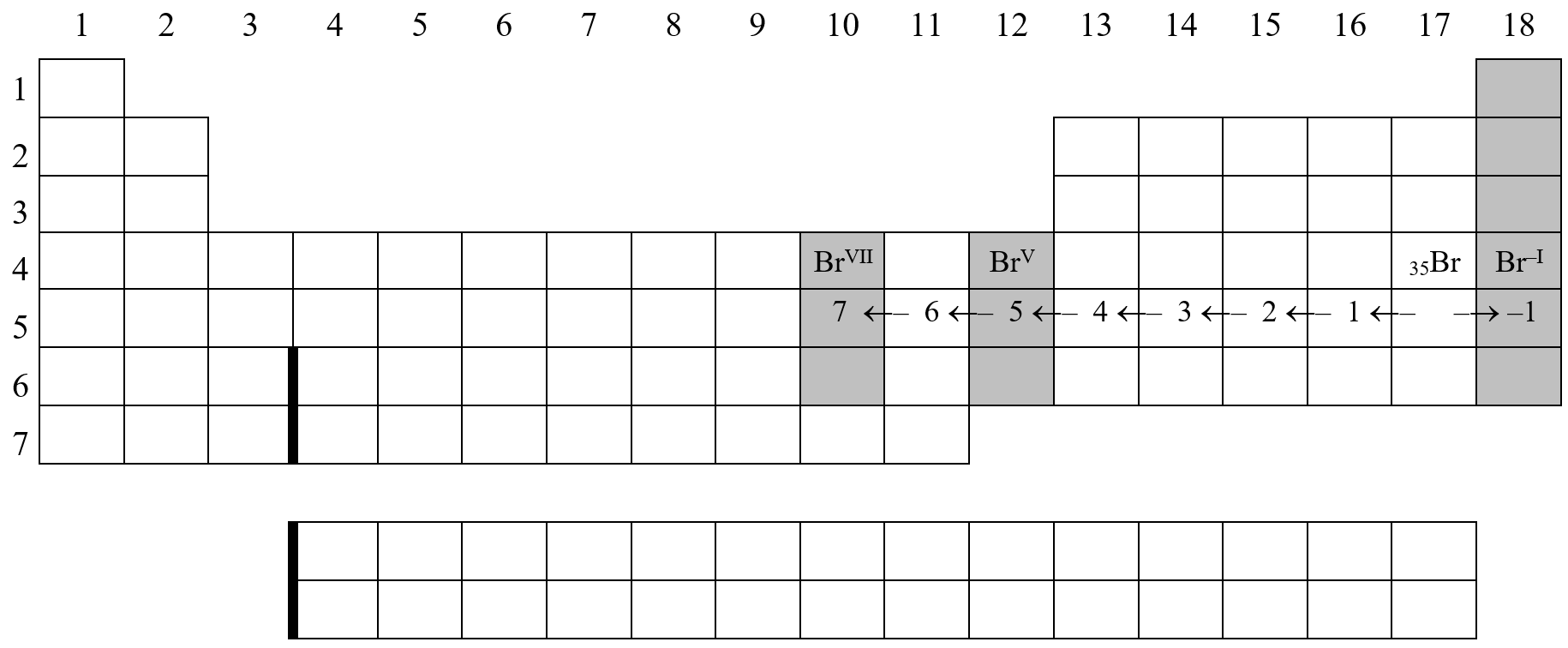
-
prvek obvyklé oxidační číslo konfigurace iontu slovní označení konfigurace \(\ce{Te}\): \(\ce{Te^{-II}}\) \(\ce{[Xe]}\) elektronový oktet \(\ce{Te^{IV}}\) \(\ce{[Cd]}\) elektronová dvacítka \(\ce{Te^{VI}}\) \(\ce{[Pd]}\) elektronová osmnáctka

Příklady souvislosti mezi strukturou elektronového obalu a chemickými a fyzikálními vlastnostmi prvků
Například:
| \(\ce{Na}\): | \(\ce{[Ne] 3s^1}\) | prudce reaktivní, snaží se získat konfiguraci \(\ce{[Ne]}\), to vede ke vzniku iontu \(\ce{Na^{+}}\) |
| \(\ce{Na^{+}}\): | \(\ce{[Ne]}\) | málo reaktivní |
| \(\ce{F}\): | \(\ce{[He] 2s^2 2p^5}\) | prudce reaktivní, snaží se získat konfiguraci \(\ce{[He] 2s^2 2p^6}\) neboli \(\ce{[Ne]}\), to vede ke vzniku iontu \(\ce{F-}\) |
| \(\ce{F-}\): | \(\ce{[Ne]}\) | málo reaktivní |
8.2.3 Periodicita fyzikálně chemických vlastností prvků
Bude probrána periodicita těchto vlastností:
- atomové a iontové poloměry
- ionizační energie
- elektronová afinita
- elektronegativita
- oxidační čísla
Periodicita atomových a iontových poloměrů
K některým účelům se v chemii používá kuličkový model znázornění atomu – atom si v tomto modelu představujeme jako kouli; jádro atomu je středem této koule, rozměry atomu (= elektronového obalu) jsou rovny rozměrům této koule. Pokud však jde o představu o tvaru a rozměrech atomu, je tento model velmi nepřesný až nepřijatelný.
Ve výuce chemie na základní a střední škole se hovoří o průměru jádra a o průměru celého atomu. Kuličkový model svádí k představě, že průměr atomu je průměrem koule nahrazující atom. Taková představa je však zcela nesprávná. Podle vlnově mechanického modelu se elektrony v elektronovém obalu nacházejí v orbitalech, které ovšem nemají jednoznačně definovanou hranici. Elektronová hustota je v blízkosti jádra větší a s rostoucí vzdáleností od jádra klesá, nikoli však až na nulovou hodnotu. „Okraj“ atomových orbitalů je definován pomocí zvolené pravděpodobnosti výskytu elektronu v daném orbitalu. Ta se však může v různých odborných studiích a kvantově-chemických výpočtech lišit (\(90\,\%\), \(95\,\%\), \(99\,\%\)). Podle volby pravděpodobnosti se pak liší také rozměry atomových orbitalů; na volbě pravděpodobnosti by proto závisely i rozměry atomu, což není logické (viz kapitola 17.7).
Proto se rozměry atomu definují jiným, objektivním způsobem, a to pomocí mezijaderných vzdáleností v chemické vazbě.
Při určování poloměrů atomů se vychází z dvojatomových molekul prvků: Polovina mezijaderné vzdálenosti je rovna atomovému poloměru tohoto prvku (Obr. 8-11 vlevo). Pak se určí mezijaderné vzdálenosti ve sloučeninách obsahujících jeden z prvků, jejichž poloměr byl již určen výše uvedeným způsobem, a jeden prvek jiný. Jeho poloměr se pak vypočte odečtením, jak znázorňuje Obr. 8-11 vpravo.

Podle způsobu, jakým jsou atomy k sobě vázány, se poloměry atomů klasifikují např. na kovalentní, kovové a iontové poloměry. Kovalentní poloměr závisí na vázaných prvcích a násobnosti vazby.
Vysvětlení vyplývá ze struktury elektronového obalu. Ve skupinách ve směru shora dolů valenční elektrony obsazují orbitaly se stále vyšším hlavním kvantovým číslem. Proto , tedy čím níže ve skupině daný prvek leží, tím dále od jádra se nacházejí valenční elektrony, což vede ke zvyšování atomového poloměru.
V periodách musíme vzít v úvahu tzv. efekt stínění a efektivní náboj jádra. Efektivní náboj jádra se hodnotí vzhledem ke konkrétnímu elektronu z obalu. Větší efektivní náboj jádra elektrony přitahuje větší silou, tj. přitáhne je blíže k jádru. Efektivní náboj jádra \(\ce{Z_{ef}}\) (uváděný v násobcích elektrického náboje protonu) se počítá ze vztahu \(\ce{Z_{ef} = Z - S}\), kde Z je protonové číslo daného atomu a S je tzv. stínící konstanta pro zvolený elektron.
Určit přesnou velikost stínící konstanty je obtížné. Nejednodušší (a dosti nepřesný) odhad její hodnoty je počet elektronů nacházejících se blíže k jádru, než zvolený elektron, tj. ve slupkách s nižším hlavním kvantovým číslem, než kde se nachází zvolený elektron. Tato představa postačuje pro vysvětlení poklesu poloměrů u p-prvků ve směru zleva doprava v periodické tabulce. Např. v druhé periodě (Tab. 10):
| Prvek | \(\ce{B}\) | \(\ce{C}\) | \(\ce{N}\) | \(\ce{O}\) | \(\ce{F}\) |
|---|---|---|---|---|---|
| \(\ce{Z}\) | \(5\) | \(6\) | \(7\) | \(8\) | \(9\) |
| \(\ce{S}\) | \(2\) | \(2\) | \(2\) | \(2\) | \(2\) |
| \(\ce{Z_{ef} = Z - S}\) | \(5 - 2 = 3\) | \(6 - 2 = 4\) | \(7 - 2 = 5\) | \(8 - 2 = 6\) | \(9 - 2 = 7\) |
| Atomový poloměr (pm) | \(85\) | \(70\) | \(65\) | \(60\) | \(50\) |
Pro d- nebo f-prvky již tento jednoduchý odhad nepostačuje (Tab. 11):
| Prvek | \(\ce{Ti}\) | \(\ce{Ni}\) | \(\ce{Ce}\) | \(\ce{Tm}\) | |
|---|---|---|---|---|---|
| \(\ce{Z}\) | \(22\) | \(28\) | \(58\) | \(69\) | |
| \(\ce{S}\) | \(20\) | \(26\) | \(56\) | \(67\) | |
| \(\ce{Z_{ef} = Z - S}\) | \(22 – 20 = 2\) | \(28 – 26 = 2\) | \(58 – 56 = 2\) | \(69 – 67 = 2\) | |
| Atomový poloměr (pm) | \(132,4\) | \(115,4\) | \(185\) | \(175\) |
Odhad stínící konstanty sice je možno upřesnit pomocí tzv. Slaterových pravidel, ale u lanthanoidů a aktinoidů ani ta nepostačují, využijeme proto tabelované údaje vypočtené z vazebných energií (Tab. 12):
| Prvek | \(\ce{Ti}\) | \(\ce{Ni}\) | \(\ce{Ce}\) | \(\ce{Tm}\) | |
|---|---|---|---|---|---|
| \(\ce{Z}\) | \(22\) | \(28\) | \(58\) | \(69\) | |
| \(\ce{S_{(tab)}}\) | \(19,166\) | \(25,003\) | \(54,172\) | \(64,955\) | |
| \(\ce{Z_{ef(tab)} = Z - S_{(tab)}}\) | \(2,834\) | \(2,997\) | \(3,828\) | \(4,045\) | |
| Atomový poloměr (pm) | \(132,4\) | \(115,4\) | \(185\) | \(175\) |
Skutečnost, že s rostoucím protonovým číslem u lanthanoidů či aktinoidů sice stínící konstanta také roste, ale pomaleji než protonové číslo prvků, se vysvětluje pomocí velké difúznosti f-orbitalů, které ke stínění přispívají méně než např. s- nebo p-orbitaly. Proto s rostoucím protonovým číslem u lanthanoidů (aktinoidů) roste efektivní náboj jádra působící na valenční elektrony, spolu s ním pak přitažlivá síla působící na valenční elektrony. Důsledkem je postupný pokles atomového poloměru lanthanoidů (aktinoidů) s jejich rostoucím protonovým číslem, nazývaný lanthanoidová (aktinoidová) kontrakce. Ve srovnání s p-prvky je pokles atomových i iontových poloměrů menší. Níže (Tab. 13) jsou uvedeny vybrané příklady:
| Prvek | \(\ce{Ce}\) | \(\ce{Pm}\) | \(\ce{Tb}\) | \(\ce{Ce}\) | \(\ce{Tm}\) |
|---|---|---|---|---|---|
| \(\ce{Z}\) | \(58\) | \(61\) | \(65\) | \(68\) | \(69\) |
| \(\ce{S_{(tab)}}\) | \(54,172\) | \(57,168\) | \(61,061\) | \(63,980\) | \(64,955\) |
| \(\ce{Z_{ef(tab)} = Z - S_{(tab)}}\) | \(3,828\) | \(3,832\) | \(3,939\) | \(4,020\) | \(4,045\) |
| Atomový poloměr (pm) | \(185\) | \(185\) | \(175\) | \(175\) | \(175\) |
Na Obr. 8-12 a Obr. 8-13 jsou pro doložení periodicity uvedeny příklady konkrétních hodnot atomových, resp. iontových poloměrů.

Šedě jsou vyplněny kroužky znázorňující atomy prvků, jejichž chemické značky jsou zapsány v grafu.

Šedě jsou vyplněny kroužky znázorňující ionty prvků, jejichž chemické značky jsou zapsány v grafu.
Poloměr atomu prvku není ve všech sloučeninách přesně stejný (závisí na charakteru vazby), v tabulkách se udávají střední hodnoty těchto veličin.
Periodicita ionizační energie
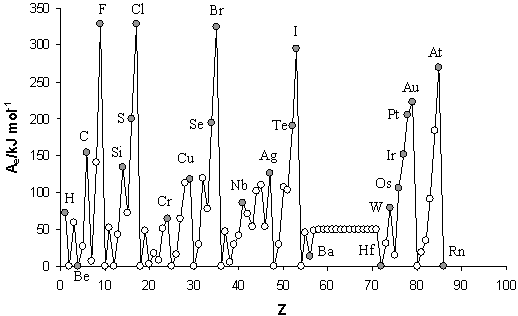
Ionizační energie (energie potřebná k odtržení valenčního elektronu od atomu a ke vzniku iontu) má výrazně periodickou závislost na protonovém čísle. Se stoupajícím protonovým číslem ve skupinách klesá a v periodách roste. Je to dáno pevností vazby elektronu k atomu. Obecně v souladu s Coulombovým zákonem platí, že tato síla je nepřímo úměrná vzdálenosti elektricky nabitých částic. Proto větší atomy mají menší ionizační energii. K anomáliím této periodicity dochází u elektronové konfigurace elektronové dvacítky (viz kapitola 8.2.2). První ionizační energie má vztah k elektronové konfiguraci. Stabilnější základní stav odpovídá vyšší první ionizační energii. (Obr. 8-14)

Periodicita elektronové afinity
Elektronová afinita (energie uvolněná při vzniku aniontu z elektricky neutrálního atomu) má obdobnou periodicitu jako ionizační energie: Se stoupajícím protonovým číslem ve skupinách klesá a v periodách roste, výjimkou jsou pouze vzácné plyny, které tvoří anionty neochotně. Proto mají elektronovou afinitu nízkou. Prvky s vysokou tendencí přijímat elektrony mají také vysoké hodnoty elektronové afinity.
Poznámka:
První ionizační energie a elektronová afinita mají v tabulce stejný průběh, pouze u vzácných plynů a prvků s konfigurací elektronové dvacítky se chovají opačně (první ionizační energie je u těchto prvků velká a elektronová afinita je malá).
Periodicita elektronegativity
Pro všechny definice elektronegativity zmíněné v tomto studijním materiálu platí, že elektronegativita má obdobnou periodicitu jako elektronová afinita a ionizační potenciál: V periodách ve směru zleva doprava se elektronegativita zvyšuje, ve skupinách klesá s rostoucím protonovým číslem.


Periodicita oxidačních čísel
V dalším textu je výraz „oxidační číslo atomu prvku“ zkrácen na „oxidační číslo prvku“.
Oxidační číslo jednotlivých prvků (atomů) píšeme za značku prvku napravo nahoru římskou číslicí. Znaménko „plus“ se nepíše, znaménko „minus“ se píše před číslici, např. \(\ce{Na^{I}}\) nebo \(\ce{Cl^{-I}}\).
Určení oxidačního čísla přímo z definice se v mnoha případech ukazuje jako nepraktické, neboť to vyžaduje znalost elektronegativit velkého množství prvků a znalosti o násobnosti vazeb. Z toho důvodu se v anorganické chemii využívají pro určení oxidačních čísel prvků následující pravidla (plynoucí z výše uvedené definice):
- Oxidační čísla prvků v elementárním stavu jsou rovna nule, např. \(\ce{Cl^0_2, Na^0, P^0_4, O^0_3, S^0_8}\).
- Atomy některých prvků mají ve všech svých běžných sloučeninách a iontech stálé oxidační číslo, např. \(\ce{F^{-I}, Li^{I}, Na^{I}, K^{I}, Rb^{I}, Cs^{I}, Be^{II}, Mg^{II}, Ca^{II}, Sr^{II}, Ba^{II}, Zn^{II}, B^{III}, Al^{III}}\).
- Oxidační číslo vodíku je ve většině sloučenin \(\ce{I}\): \(\ce{H^{I}Cl, H^I2O, H^{I}_2SO4, NaOH^{I}}\)
Existují výjimky (hydridy alkalických kovů a kovů alkalických zemin), v nichž má vodík oxidační číslo \(\ce{-I}\): \(\ce{LiH^{-I}, CaH^{-I}2}\) apod. - Prvky 17. skupiny mají v binárních bezkyslíkatých sloučeninách oxidační číslo \(\ce{-I}\): \(\ce{KI^{-I}, HBr^{-I}, FeCl^{-I}3}\) apod.
- Oxidační číslo kyslíku je ve většině sloučenin \(\ce{-II}\): \(\ce{Al2O3^{-II}, KO^{-II}H, H2O^{-II}}\) apod.
Výjimku tvoří:- peroxidy (anion \(\ce{O^{2-}2}\)): \(\ce{CaO^{-I}2, H2O^{-I}2, \ldots}\)
- hyperoxidy, které obsahují anion \(\ce{O^{-}_2}\): \(\ce{KO2, CsO2}\)
- ozonidy (anion\(\ce{O^{-}_3}\)): \(\ce{LiO3}\)
- a fluoridy kyslíku, kde je oxidační číslo kyslíku kladné: \(\ce{O^{II}F2}\)
- Atom síry má často oxidační číslo \(\ce{-II}\) (kromě disulfidů a kyslíkatých sloučenin síry):
\(\ce{ZnS^{-II}, H2S^{-II}, \ldots}\)
V disulfidech má atom síry oxidační číslo \(\ce{-I}\) (obsahují anion \(\ce{S^{2-}2}\), což je obdoba peroxidů): \(\ce{H2S^{-I}2, Cl2S^{-I}2,\ldots}\) - Součet oxidačních čísel všech atomů v elektroneutrální molekule je \(0\). \begin{array}{ll} \ce{Ba^{II}Bl^{-I}2} \qquad & 2+2\cdot (-1)=0\\ \ce{K^{I}O^{-II}H^{I}} \qquad & 1+(-2) + 1=0 \end{array}
- V kationtech a aniontech je součet oxidačních čísel roven nábojovému číslu iontů, např. \begin{array}{lll} \ce{NH4+:} \quad & \ce{N^{-III}, 4H^{I}:} \quad & -3+4\cdot 1 = 1 \\ \ce{SO^{2-}4:} & \ce{S^{VI}, 4O^{-II}:} \quad & 6+4\cdot (-2) = -2 \end{array}
- Vazba ligandu na centrální atom v koordinační sloučenině vzniklá koordinací nevyvolává změnu oxidačního čísla ani centrálního atomu, ani donorového atomu ligandu.
- V případě sloučenin, kde jsou navzájem vázané atomy téhož prvku, můžeme podle předcházejících pravidel určovat průměrné oxidační číslo atomu, pro které někdy vycházejí i necelé hodnoty (např. pro dusík v kyselině azidovodíkové \(\ce{HN3}\), pro jod v trijodidu draselném \(\ce{KI3}\), pro kyslík v ozonidu lithném \(\ce{LiO3}\) nebo hyperoxidu draselném \(\ce{KO2}\) apod.). Protože takovýmto hodnotám oxidačního čísla je obtížné připsat fyzikální význam, uvádí se místo něj obvykle nábojové číslo (Ewensovo-Bassettovo číslo) celé homoatomové skupiny, např. \(\ce{(N3)^{-}, (I3)^{-}, (O3)^{-}, (O2)^{-}}\).
V organických sloučeninách by bylo určení oxidačního čísla uhlíku ve většině případů natolik problematické a přitom formální, že se od takových snah obvykle upouští.
Vyznačení oxidačního čísla se provádí:
- ve vzorci: římskými číslicemi vpravo nahoru ke značce prvku (Stockovo číslo). \(\ce{Cl^{-I}, O^{-II}}\)
- v názvu:
- římskými číslicemi v kulaté závorce za název prvku (jen vzácně – viz dále)
- koncovkou:
- záporné oxidační číslo: koncovka –id bez ohledu na velikost oxidačního čísla: \(\ce{F^{-I}}\)… fluorid, \(\ce{O^{-II}}\)… oxid, \(\ce{S^{-II}}\)… sulfid, \(\ce{H^{-I}}\)… hydrid
- kladné oxidační číslo: soustavou názvoslovných zakončení, závisejících na velikosti oxidačního čísla
Tab. 14: Názvoslovná zakončení pro vyznačení kladného oxidačního čísla.
Formální náboj (nábojové číslo) iontu je v některých případech zapotřebí od oxidačního čísla pečlivě rozlišovat, podobně jako je zapotřebí rozlišovat použití arabských a římských čísel:
Stockovo číslo = oxidační číslo atomu. Zapisuje se římskými číslicemi.
| \(\ce{U^{VI}O2SO4}\) | síran uranylu(VI) | Zápis „\(\ce{U^{VI}}\)“ znamená, že uran má v této sloučenině oxidační číslo VI. |
Ewensovo-Bassettovo číslo = formální elektrický náboj (nábojové číslo) iontu. Zapisuje se arabskými číslicemi.
| \(\ce{UO2^{2}+}\) | uranyl(2+) | Zápis „uranyl(2+)“ znamená, že skupina \(\ce{UO2}\) (tj. uranyl) má celkový formální náboj 2+. |
| \(\ce{UO2SO4}\) | síran uranylu(2+) |
Způsob zápisu Stockova a Ewens-Bassettova čísla je nutno pečlivě odlišovat, jak ilustruje následující schéma:
Protože na hodnotu oxidačního čísla prvků ve sloučeninách má vliv více faktorů, není možné vyslovit jednoduchou definici, která by vyjadřovala vztah mezi oxidačním číslem prvků obecně ve všech sloučeninách a elektronovou konfigurací jejich atomů. Tento vztah však lze nalézt pro určité typy sloučenin a pro určitá oxidační čísla řady prvků.
Atomy prvků se snaží nabýt elektronové konfigurace nejbližšího vzácného plynu (primární periodicita), případně elektronové osmnáctky nebo dvacítky (sekundární periodicita). Z toho plynou obvyklá oxidační čísla prvků.
Maximální kladné oxidační číslo prvku souvisí s jeho postavením v periodické soustavě prvků.
Prvky 1. a 11. skupiny mají maximální kladné oxidační číslo I.
Prvky 2. a 12. skupiny mají maximální kladné oxidační číslo II.
Prvky 3. a 13. skupiny mají maximální kladné oxidační číslo III.
Prvky 4. a 14. skupiny mají maximální kladné oxidační číslo IV.
Prvky 5. a 15. skupiny mají maximální kladné oxidační číslo V.
Prvky 6. a 16. skupiny mají maximální kladné oxidační číslo VI.
Prvky 7. a 17. skupiny mají maximální kladné oxidační číslo VII.
Prvky 8., 9., 10. skupiny mají maximální kladné oxidační číslo VIII.
Výjimku nacházíme u kyslíku, fluoru a u prvků 8. a 18. skupiny. Maximální kladné oxidační stavy některých z těchto prvků jsou nižší. Kyslík neochotně nabývá jakéhokoli kladného oxidačního čísla, fluor má ve všech svých sloučeninách jen záporné oxidační číslo. U vzácných plynů a prvků 8. skupiny se dosud nepodařilo připravit sloučeniny, v nichž by tyto prvky dosáhly oxidačního čísla VIII, výjimkou je xenon.
Jinou výjimkou jsou naopak vyšší maximální pozitivní oxidační čísla běžně pozorovatelná u prvků 11. skupiny. Např. měď se kromě ve stálém oxidačním stavu I běžně vyskytuje i v oxidačním stavu II a dokonce i v nestálém oxidačním stavu III. Obdobně je tomu u Ag i Au.
Z postavení prvku v periodickém systému prvků lze vyčíst i jeho nejnižší záporné oxidační číslo. Vznikající anionty se snaží nabýt stabilní elektronové konfigurace, tj. konfigurace nejbližšího následujícího vzácného plynu. Proto:
Prvky 17. skupiny mají nejnižší záporné oxidační číslo -I.
Prvky 16. skupiny mají nejnižší záporné oxidační číslo -II.
Prvky 15. skupiny mají nejnižší záporné oxidační číslo -III.
Prvky 14. skupiny mají nejnižší záporné oxidační číslo -IV.

