5 Jádro atomu, radioaktivita, jaderné reakce
5.1 Základní pojmy
Atom v chemickém textu obvykle zapisujeme pomocí chemické značky příslušného prvku. Ke značce prvku lze dopisovat čísla, přičemž jejich význam je jednoznačně určen místem, kam ke značce prvku číslo umístíme.
\[\ce{{\Large^{A}_{Z}X^{z}_{n}}\qquad\qquad A=Z +N}\]| \(\ce{X}\) | obecné označení značky prvku |
| \(\ce{Z}\) | protonové (atomové) číslo udává počet protonů v jádře, pořadí prvku v periodické soustavě prvků, počet elektronů v obalu atomu (u elektricky neutrálních atomů) a velikost kladného náboje jádra. |
| \(\ce{A}\) | nukleonové (hmotnostní) číslo udává počet nukleonů v jádře (tj. součet počtu protonů a neutronů) a charakterizuje hmotnost atomu. |
| \(\ce{N}\) | neutronové číslo udává počet neutronů v jádře. Platí \(\ce{A=Z +N}\) |
| \(\ce{n}\) | počet atomů prvku \(\ce{X}\) v molekule |
| \(\ce{z}\) | nábojové číslo (počet kladných elementárních elektrických nábojů iontu) |
Prvek je chemicky čistá látka složená z atomů, které mají stejné protonové číslo. V čísle nukleonovém se atomy mohou i nemusí shodovat. Prvky mohou být jednoatomové, ale mohou tvořit i víceatomové molekuly.
Nuklid je soubor atomů téhož prvku, které mají navzájem stejný počet neutronů (Obr. 5-1 uprostřed, Obr. 5-1 vpravo). Počet neutronů se nemusí rovnat počtu protonů. Nuklid je zvláštním případem prvku.
Protože rozdíl mezi pojmy „prvek“ a „nuklid“ bývá často nejasný, uvádíme v tomto obrázku obdobu z „hmatatelného velkého“ světa. Nuklidu odpovídá soubor zrnek mouky konkrétní velikosti (např. hladká mouka, nebo hrubá mouka), termínu „prvek“ odpovídá „mouka“ bez rozlišení velikosti zrn.
Chceme-li zvlášť upozornit na skutečnost, že jádra atomů určitého prvku se od sebe liší počtem neutronů, nazveme tato odlišná jádra izotopy. Slovem „izotopy“ tedy neoznačujeme skupinu atomů určitých vlastností, ale vztah mezi atomy, resp. jejich jádry.
Např. \(\ce{^1H ×\, ^2H ×\, ^3H}\); nebo \(\ce{^16O ×\, ^17O ×\, ^18O}\).
Obdobně zavádíme pro vztah mezi jádry atomů i další označení.
Atomy jsou vůči sobě izobary, pokud jejich jádra mají stejné nukleonové číslo, ale různé protonové číslo; např. \(\ce{^{40}_{19}K × ^{40}_{20}Ca}\).
Atomy jsou vůči sobě izotony, pokud jejich jádra mají stejné neutronové číslo, ale různé protonové číslo; např. \(\ce{^{26}_{12}Mg × ^{27}_{13}Al}\).
Atomy jsou vůči sobě izomery, pokud jejich jádra mají stejné složení, ale liší se energií (a stabilitou). Jádro s vyšší energií je méně stabilní. Nazýváme je metastabilní a označujeme symbolem m vlevo nahoře u značky prvku (např. \(\ce{^{99m}Tc}\) a \(\ce{^{99}Tc}\) jsou dva rozdílné radionuklidy).
5.2 Hmotnost jádra
Jádro atomu je tvořeno protony a neutrony, které se souhrnně nazývají nukleony (o fundamentálních částicích, jejich vlastnostech a stavbě atomu pojednává podrobněji kapitola 2).
- protony – elektrický náboj \(\ce{Q_{p}} = + 1,602\,189\,2 \cdot 10^{-19}\,\ce{C}\) hmotnost protonu \(\ce{m_{p}} = 1,672\,648\,5 \cdot 10^{-27}\,\mathrm{kg}\)
- neutrony – elektrický náboj \(\ce{Q_{n}} = 0\,\ce{C}\) hmotnost neutronu \(\ce{m_{n}} = 1,674\,954\,3 \cdot 10^{-27}\,\ce{kg}\)
Hmotnost jádra je menší než součet hmotností všech nukleonů (ve volném stavu), z nichž se jádro skládá. Tento jev se nazývá hmotnostní defekt.
Příčinou hmotnostního defektu je skutečnost, že při vzniku jádra z nukleonů se uvolňuje energie (tato energie se nazývá vazebná energie jádra). Podle spojeného zákona zachování hmotnosti a energie pak úměrně klesne hmotnost jádra (více viz kapitola 3).
5.3 Stabilita jádra
Mluvíme-li v chemii nebo fyzice o stabilitě, musíme odlišovat mezi stabilitou termodynamickou a stabilitou kinetickou.
Z termodynamického hlediska jsou nestabilní ta jádra, při jejichž přeměně je uvolňována energie. Aby bylo možno srovnávat vazebnou energii jádra pro různé prvky a různé nuklidy, zavádí se tzv. vazebná energie jádra vztažená na jeden nukleon vztahem:
| \(\varepsilon_{j,A}\) | vazebná energie jádra vztažená na jeden nukleon |
| \(\varepsilon_j\) | vazebná energie (celého) jádra |
| \(A\) | nukleonové číslo |
Čím větší má \(\mathrm{\varepsilon_{j,A}}\) hodnotu, tím je dané jádro stabilnější.
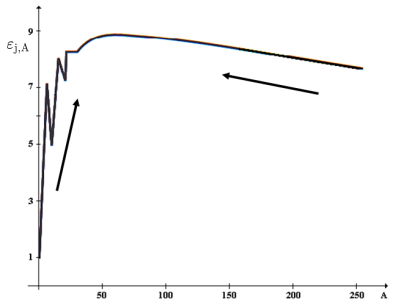
Šipky vyznačují směr samovolné přeměny jader. Upraveno dle http://fyzika.jreichl.com/data/Mikro_4jaderka_soubory/image019.png.
Nejstabilnější jsou jádra s největší vazebnou energií \(\mathrm{\varepsilon_{j,A}}\). Z Obr. 5-2 plyne, že se nejstabilnější jádra nachází kolem nukleonového čísla 50-100 (okolí železa). Při vzniku těchto jader se uvolní více energie, než kolik je zapotřebí dodat na zánik jader výrazně lehčích nebo výrazně těžších. Lehká jádra proto podléhají syntéze na jádra těžší (stabilnější), těžká jádra podléhají štěpným reakcím na jádra lehčí (stabilnější). Oba uvedené děje jsou doprovázeny uvolňováním energie.
Při posuzování stability jader podle \(\mathrm{\varepsilon_{j,A}}\) si musíme uvědomit, že jde o stabilitu termodynamickou. Ve skutečnosti se však výsledný z termodynamického hlediska stabilní stav může v některých případech ustalovat tak pomalu, že tyto přeměny nejsme s využitím současných měřicích metod schopni zachytit. Z tohoto důvodu je při posuzování stability jader nutno brát v úvahu také kinetické hledisko. Všechna jádra, která nejeví pozorovatelné známky samovolné přeměny (podle současných znalostí a s využitím současných měřicích metod) pokládáme z kinetického hlediska za stabilní, i pokud by z termodynamického hlediska stabilní nebyla.
Odhad kinetické stability jader
Zatím nejsme schopni určovat kinetickou stabilitu jednotlivých jader na základě exaktních zákonitostí, ale spokojujeme se jen s několika empirickými pravidly a modely. Tato empirická pravidla (zejména skutečnost, že největší počet stabilních jader v přírodě jsou jádra sudo-sudá (jádra se sudým počtem protonů a současně se sudým počtem neutronů)) vedla k závěru, že jádro má určitou strukturu (tzv. slupkový model jádra) a že při zaplňování jednotlivých energetických hladin v jádře mají neutrony a protony snahu vytvářet páry (tj. dvojice), které dávají nejstabilnější konfigurace. Dále bylo zjištěno, že jádra obsahující 2, 8, 20, 28, 50, 82, pravděpodobně i 114, 126, 164, 184 protonů nebo neutronů jsou obzvláště stabilní (tzv. magická čísla).
Pro stabilitu izobarů platí Mattauchovo izobarické pravidlo: Neexistují stabilní izobary, lišící se protonovým číslem o jednotku. Např. v trojici \(\ce{^{40}_{18}Ar, ^{40}_{19}K, ^{40}_{20}Ca}\), je \(\ce{^{40}_{19}K}\) radioaktivní.
U prvků s protonovým číslem \(\mathrm{Z \leq 20}\) jsou kineticky nejstabilnější ta jádra, u nichž je \(\mathrm{N : Z = 1}\). V jádrech atomů s vyšším atomovým číslem (přibližně \(\mathrm{Z = 21 - 84}\)) se již protony v jádře díky svým shodným nábojům elektrostaticky tak silně odpuzují, že stabilnější jsou jádra, v nichž je více neutronů než protonů. Poměr \(\mathrm{N : Z}\) tedy pro stabilní jádra s rostoucím Z roste postupně až na hodnotu 1,5. Stabilní jádra vytvářejí tzv. řeku stability (Obr. 5-3).
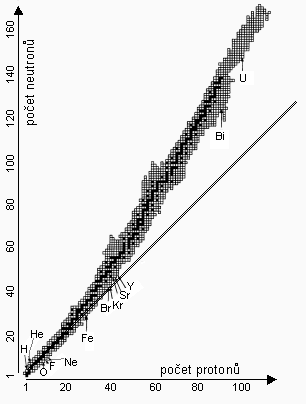
5.4 Radioaktivita
Radioaktivita je schopnost atomu samovolně se dříve nebo později přeměnit v jiný atom za současného vysílání radioaktivního (jaderného) záření. Radioaktivitu objevil A. H. Becquerel (1896) a ukázal, že je vlastností některých atomů bez ohledu na to, zda jsou součástí volné, či součástí sloučenin.
Do dnešní doby je známo kolem 50 přírodních nuklidů, které se vyznačují radioaktivitou. Zde hovoříme o přirozené radioaktivitě (při ní dochází k vysílání záření trojího druhu: \(\mathrm{\alpha}\), \(\mathrm{\beta -}\) nebo \(\mathrm{\gamma}\)) na rozdíl od tzv. umělé radioaktivity, kterou se vyznačuje velké množství nuklidů připravených uměle. První umělý radionuklid byl připraven ozařováním hliníku částicemi \(\mathrm{\alpha}\) (I. a F. Joliot-Curie, 1934).
Vznikající \(\ce{^{30}_{15}P}\) je radioaktivní.
\[\ce{^{30}_{15}P -> ^{30}_{14}Si + ^0_{+1}e}\]Částice \(\ce{^0_{+1}e}\) je pozitron (mikročástice lišící se od elektronu pouze opačným znaménkem elektrického náboje).
Uvedená přeměna \(\ce{^{27}_{13}Al}\) na \(\ce{^{30}_{15}P}\) je příkladem jednoduché jaderné reakce, tj. interakce atomového jádra s jiným jádrem (nebo mikročásticí), při níž vzniká jedno nebo více nových jader a často také jedna nebo několik mikročástic. První umělá jaderná reakce byla pozorována při ozařování nuklidu \(\ce{^{14}_{7}N}\) částicemi \(\mathrm{\alpha}\) (E. Rutherford, 1919).
\[\ce{^{14}_{7}N + ^4_2\alpha -> ^{17}_{8}O + ^1_1p}\]5.4.1 Vlastnosti radioaktivního záření
Radioaktivní záření způsobuje ionizaci (tj. zvýšený vznik iontů) prostředí, kterým prochází. Proto je označováno také jako záření ionizující.
Záření alfa je ionizující záření tvořené rychle letícími částicemi alfa (jádra helia): \(\ce{^4_2\alpha}\), neboli \(\ce{^4_2He^{2}+}\). Zdrojem záření alfa jsou obvykle těžké radionuklidy, např. \(\ce{^{241}Am}\) nebo \(\ce{^{226}Ra}\). Záření alfa má čárové spektrum. To znamená, že každý radionuklid emituje částice alfa pouze o určitých energiích. Částice \(\alpha\) nesou dva kladné elementární náboje a jejich nukleonové číslo je 4. Díky poměrně velké hmotnosti letících částic není alfa záření příliš pronikavé a jeho dosah je relativně malý. Ve vzduchu činí jen několik centimetrů, ve vodě nebo tkáni jen zlomky milimetrů. Ochrana před \(\alpha\) částicemi nepředstavuje tedy větší problém: stačí brýle a rukavice.
Záření beta je tvořeno rychle letícími elektrony: \(\ce{^0_{-1}\beta}\left(\ce{^{0}_{-1}e-}\right)\) nebo pozitrony \(\ce{^0_{+1}\beta}\left(\ce{^{0}_{+1}e+}\right)\). Vzniká při přeměně mnoha radionuklidů, např. \(\ce{^{32}P}\), \(\ce{^{90}Sr}\). Zde je nutno připomenout, že radioaktivita je záležitostí jádra atomu, které však elektrony ani pozitrony přímo neobsahuje. Uvedené částice \(\beta\) tedy musejí při jaderném ději vznikat přímo v jádře atomu. Děje se to některým z následujících způsobů:
- u zářičů \(\beta^-\): \(\ce{n -> p+ + e- + v^{'}_{e}}\) \(\ce{v^{'}_{e}}\) .......... elektronové antineutrino
\(\ce{^{32}_{15}P -> ^{32}_{16}S + ^0_{-1}e + v^{'}_{e}}\) - u zářičů \(\beta^+\): \(\ce{p+ -> n + e+ + v_{e}}\) \(\ce{v_{e}}\) .......... elektronové neutrino
\(\ce{^{11}_{6}C -> ^{11}_{5}B + ^0_{+1}e + v_{e}}\) - u zářičů EZ (elektronový záchyt – zachycený elektron pochází z elektronového obalu): \(\ce{p+ + e- -> n + v_{e}}\)
\(\ce{^{7}_{4}Be + ^{0}_{-1}e -> ^7_{3}Li + v_{e}}\)
Elektron a antineutrino, resp. pozitron a neutrino jsou z jádra vymrštěny různými směry a různými rychlostmi, přičemž součet jejich kinetických energií je pro daný zářič (tj. radionuklid) konstantní. Záření beta tedy obsahuje částice \(\beta\) s energií od nuly až po určitou maximální hodnotu \(\ce{E_{max}}\) (má tedy spojité spektrum). Hodnoty \(\ce{E_{max}}\) u běžně používaných radionuklidů činí \(10^4\) až \(10^6\ \ce{eV}\). Pronikavost beta záření je větší než u \(\alpha\) částic, může pronikat materiály s nízkou hustotou nebo malou tloušťkou. Jako ochranu proti beta záření používáme plexisklové a skleněné desky.
Záření gama je elektromagnetické záření (proud fotonů) jaderného původu. Vzniká při radioaktivní přeměně řady radionuklidů, často současně či následně po přeměně alfa nebo beta. K nejčastěji používaným \(\gamma\)-zářičům patří \(\ce{^{60}Co}\) a \(\ce{^{137}Cs}\). Záření gama má čárové spektrum – daný radionuklid tedy emituje pouze fotony s určitými energiemi, které jsou pro jeho přeměnu charakteristické. Gama záření má krátkou vlnovou délku \(\left(10^{-10} - 10^{-13}\,\mathrm{m}\right)\).
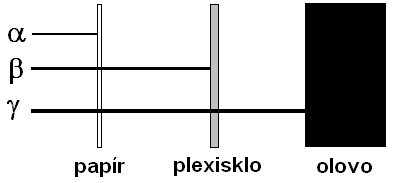
Alfa záření lze odstínit listem papíru. Záření beta lze zachytit 1 cm plexiskla nebo 1 mm olova. Záření gama je nejpronikavější. Nemůžeme je zcela odstínit, ale pouze snížit jeho intenzitu. K tomu se používá několik centimetrů silná vrstva olova nebo jiného materiálu s velkou hustotou.
5.4.2 Chování radioaktivních paprsků v elektrickém a magnetickém poli
Záření gama (jakožto elektromagnetické záření) není elektrickým ani magnetickým polem ovlivňováno (chová se vůči nim stejně jako světlo).
Záření alfa a beta je elektrickým i magnetickým polem ovlivňováno, a to podle pravidel pro chování elektricky nabitých částic:
- chování v elektrickém poli: Obecně platí, že částice s opačným elektrickým nábojem se přitahují, se stejným elektrickým nábojem se odpuzují.
- chování v magnetickém poli: Na elektricky nabité částice s nábojem \(\mathrm{Q}\) pohybující se v magnetickém poli o intenzitě \(\mathrm{\vec{B}}\) působí Lorentzova síla. Orientaci Lorentzovy síly určíme například pomocí pravidla pravé ruky: Umístíme-li pravou ruku tak, aby prsty ukazovaly původní směr pohybu elektricky nabité částice a vektor magnetické indukce vstupoval do dlaně ruky a vystupoval hřbetem ven, pak palec ukáže směr, kterým se vychýlí záporně nabitá pohybující se částice (např. elektron). Kladně nabitá částice se vychýlí na stranu opačnou.
5.4.3 Zákon posunu
Zákon zachování protonového čísla, zákon zachování nukleonového čísla
Zákon posunu vyslovil nejprve F. Soddy, nezávisle na nějm jej doplnili A. S. Russel a K. Fajans: Zákon posunu je historicky starší než výše uvedený zákon zachování protonového čísla a zákon zachování nukleonového čísla.
- Vyzáří-li jádro částici \(\alpha\), klesne počet protonů v jádře o 2 a vznikne nový atom, stojící v periodické soustavě o dvě místa vlevo od atomu původního. Počet nukleonů klesne o 4. \[\ce{^{A}_{Z}X -> ^4_2\alpha + ^{A-4}_{Z-2}Y}\]
- Vyzáří-li jádro částici \(\beta^-\), vzroste protonové číslo o jednotku, počet nukleonů zůstane zachován: \[\ce{^{A}_{Z}X -> ^0_{-1}e- + ^{A}_{Z+1}Y + v^{'}_{e}}\] Vyzáří-li jádro částici \(\beta^+\) nebo zachytí-li elektron, klesne protonové číslo o jednotku, počet nukleonů zůstane zachován: \[\ce{^{A}_{Z}X -> ^0_{+1}e+ + ^{A}_{Z-1}Y + v_{e}}\]
- Zářením gama se složení jádra nemění.
5.4.4 Radioaktivní přeměnové řady
Přeměnou (rozpadem) radioaktivního jádra vzniká jiné jádro. Některá takto vzniklá jádra mohou být radioaktivní a jejich přeměnou pak vznikají další jádra, která zase mohou být radioaktivní atd. Nestálost vznikajících radioaktivních jader vede ke vzniku tzv. radioaktivních přeměnových řad. Pokud jadernou přeměnou (radioaktivním rozpadem) vznikne stabilní jádro, přeměnová řada se ukončí. Jsou známy čtyři řady.
Důvod, proč radioaktivní přeměnové řady musejí být právě čtyři, je ten, že vyzářením částice α se nukleonové číslo jádra snižuje o 4, zatímco při ostatních druzích radioaktivních přeměn se nukleonové číslo nemění. O zařazení izotopu do typu řady rozhoduje dělitelnost nukleonového čísla všech členů dané řady hodnotou 4. Podle zbytku při dělení určíme typ řady (Tab. 6).
Tyto řady jsou znázorněny na Obr. 5-5.
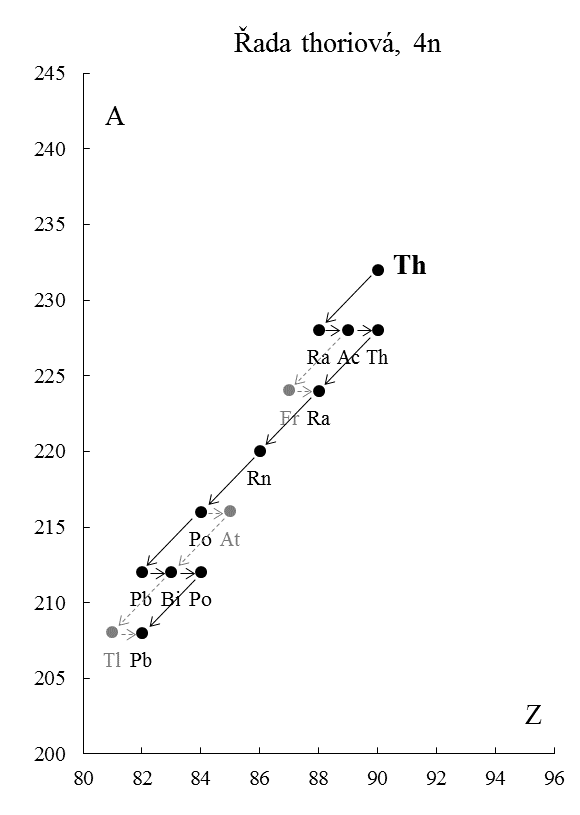



Přeměny probíhající v menšinovém rozsahu jsou vyznačeny šedou barvou a přerušovanými čarami. Mateřský prvek je zapsán věším písmem.
5.4.5 Kinetika prostých jaderných přeměn
Rychlost přeměny radioaktivních atomů se řídí základním zákonem radioaktivní přeměny:
Za dostatečně krátký časový interval se přemění vždy konstantní podíl (stálá část) z přítomného počtu atomů radionuklidu. Tento podíl se nazývá přeměnová konstanta:
\(\lambda\) je přeměnová konstanta, \(\ce{N}\) je počet atomů radionuklidu, \(\ce{\Delta N}\) je počet přeměněných atomů, \(\ce{\Delta t}\) je časový interval.
| \(N_0\ (A_0)\) | počet nepřeměněných jader (aktivita radioaktivního záření) sledovaného izotopu v čase \(\mathrm{t = 0}\) (na počátku měření) |
| \(N (A)\) | počet nepřeměněných jader (aktivita radioaktivního záření) sledovaného izotopu v libovolném čase \(t \gt 0\) (po začátku měření) |
| \(\lambda\) | přeměnová (rozpadová) konstanta |
| \(t\) | čas uplynulý od začátku měření |
| \(e\) | Eulerovo číslo (základ přirozených logaritmů; \(e=2,718\ldots\)) |
Místo přeměnové (rozpadové) konstanty \(\lambda\) se v literatuře mnohem častěji používá tzv. poločas přeměny \(\tau\), což je doba, za kterou se přemění polovina původního počtu radioaktivních jader. Převodní vztah mezi přeměnovou (rozpadovou) konstantou a poločasem přeměny je:
Odvodíme jej takto:
Jestliže po čase \(\mathrm{t}\) rovném poločasu \(\tau\) (tedy \(\mathrm{t} = \tau\) zůstává ve vzorku polovina původního počtu radioaktivních jader (tedy \(\mathrm{N=\dfrac{N_0}{2}}\)), bude po dosazení těchto podmínek do exponenciálního zákona radioaktivní přeměny platit:
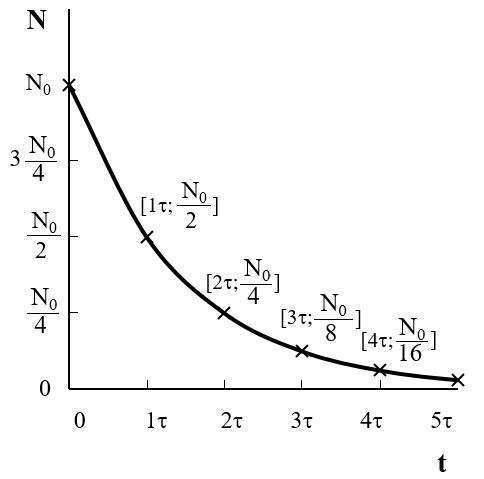
5.4.6 Jaderné reakce
K přeměně atomového jádra nemusí docházet pouze jeho samovolnou přeměnou, nýbrž i jadernou reakcí. Jadernou reakcí rozumíme přeměnu atomového jádra vyvolanou zasažením částicí buď z přirozeného zdroje (z radioaktivního zářiče), nebo ze zdroje umělého (z urychlovače částic). Historicky dříve byly známy jaderné reakce, při nichž docházelo k malé změně protonového čísla původního atomu (o hodnotu 0, 1, resp. 2), později byla objevena a vysvětlena štěpná reakce, při které se protonové číslo produktů od původního nuklidu liší podstatně více.
Jaderné reakce s malou změnou protonového čísla původního atomu
Při těchto přeměnách uvolňuje bombardované jádro jednu nebo několik lehkých částic (protonů, neutronů, elektronů) a vzniká jedno nové jádro, s protonovým a nukleonovým číslem jen málo odlišným od jádra původního. První umělá jaderná reakce byla pozorována E. Rutherfordem v roce 1919 a jednalo se právě o prostou přeměnu:
\[\ce{^{14}_7N + ^4_2\alpha -> ^{17}_8O + ^1_1p}\]V mnohých případech je nuklid vzniklý prostou přeměnou nestálý a samovolně se přeměňuje. Tento jev se nazývá umělá radioaktivita. O její objev se zasloužili manželé I. a J. F. Joliot-Curieovi.
Štěpné reakce
O objev štěpných reakcí se zasloužili O. Hahn a F. Strassmann (1939). První jadernou reakcí tohoto typu bylo rozštěpení atomového jádra uranu na dvě částice (hmotnostní poměr přibližně 2:3 - Obr. 5-7).
Při rozštěpení jádra uranu se uvolní velké množství energie a 1-3 neutrony. Ty mohou za vhodných podmínek vyvolat další štěpení, takže reakce začne probíhat rozvětveným řetězovým mechanismem, při němž počet štěpných reakcí lavinově vzrůstá (Obr. 5-8). Ve velmi krátkém časovém intervalu se rozštěpí velký počet atomových jader a tím se uvolní velké množství energie.
Jestliže rozvětvování reakčního řetězce není vhodným způsobem udržováno v patřičných mezích, probíhá děj explozivně. Takováto řetězová reakce je podstatou atomových explozí. Při využívání jaderných reakcí jako zdroje energie je proto nutno udržovat řetězovou reakci v požadovaných mezích tak, aby se počet uvolňovaných neutronů od určitého okamžiku dále nezvětšoval. Takovýto řízený průběh jaderných reakcí se uskutečňuje v zařízeních zvaných atomové reaktory. Reaktor produkuje při svém provozu převážně tepelnou energii, kterou lze zužitkovat.
Princip obohacování uranu
Přírodí uran je směsí izotopů \(\ce{^{235}U}\) a \(\ce{^{238}U}\). K štěpné reakci lze použít pouze izotop uranu \(\ce{^{235}U}\) (kterého je v přírodě jen 0,72 % z celkového množství uranu), zatímco \(\ce{^{238}U}\) (99,28 % přírodního uranu) štěpné reakci s termickými neutrony nepodléhá. Pro průmyslové využití štěpné reakce je tedy nutno přírodní uran obohatit složkou \(\ce{^{235}U}\).
Uran (pevná látka) je nejprve převeden na plynný \(\ce{UF6}\). Následně je využito skutečnosti, že molekuly \(\ce{^{235}UF6}\) jsou lehčí než molekuly \(\ce{^{238}UF6}\), takže molekuly \(\ce{^{235}UF6}\) rychleji (za daný čas ve větším množství) pronikají pórovitou přepážkou. Plyn za přepážkou obsahuje proto více \(\ce{^{235}UF6}\) než plyn před přepážkou. Říkáme, že byl složkou \(\ce{^{235}UF6}\) obohacen.
Pro obohacení přírodního uranu na úroveň využitelnou v jaderném reaktoru je nezbytné zařadit více obohacovacích kroků (řádově stovky až tisíce pórovitých přepážek).
Poměr rychlostí pronikání dvou různě těžkých molekul pórovitou přepážkou (tzv. transfúze) je popsán Grahamovým zákonem (více viz kapitola 25):
| \(\ce{M_{^{235}UF_6}}\) | molární hmotnost molekuly \(\ce{^{235}UF6}\) |
| \(\ce{M_{^{238}UF_6}}\) | molární hmotnost molekuly \(\ce{^{238}UF6}\) |
| \(\ce{v_{^{235}UF_6}}\) | rychlost pronikání molekul \(\ce{^{235}UF6}\) |
| \(\ce{v_{^{238}UF_6}}\) | rychlost pronikání molekul \(\ce{^{238}UF6}\) |
Termonukleární reakce
Termonukleární reakce jsou zdrojem zářivé energie hvězd, včetně Slunce. Teplota v těchto místech dosahuje řádově až \(10^6\, ^{\circ}C\). Podobná teplota je i v centru atomového výbuchu (termonukleární reakcí je též výbuch např. vodíkové bomby).
5.4.7 Příklady využití radioaktivity
Účinků ionizujícího záření se využívá v průmyslu, zemědělství, zdravotnictví, ochraně životního prostředí, archeologii, geologickém průzkumu a řadě dalších oblastí. V následujícím textu si podrobněji probereme pouze některé vlastnosti radioaktivního záření a jejich využití.
| vlastnost radioaktivního záření | využití |
|---|---|
| intenzita radioaktivního záření klesá s časem podle exponenciálního zákona jaderné přeměny | určení stáří vzorků obsahujících radionuklid (jaderná chronologie) |
| záření beta a gama prostupuje materiálem a je tedy detekovatelné i za neprůhlednou přepážkou | radioaktivní značení, diagnostická gamagrafie |
| záření, které prostupuje materiálem, prostupuje různými druhy materiálů různě intenzivně | defektoskopie (hledání závad materiálů), rentgenování |
| velká dávka radioaktivního záření způsobuje vážné poškození až smrt organismů | gama záření se používá pro sterilizaci obvazového materiálu apod. |
| nemocné buňky bývají radioaktivním zářením více poškozovány než buňky zdravé | léčba zhoubných nádorů ozařováním |
Jaderná chronologie
Uhlíková metoda: z poměru obsahu \(\ce{^{14}_6C : ^{12}_6C}\) ve zkoumaném objektu se určí stáří různých archeologických a paleontologických objektů mladších než 60 000 let.
Poměr \(\ce{^{14}_6C : ^{12}_6C}\) zůstává v průběhu života každého organismu konstantní. Po odumření organismu začíná obsah \(\ce{^{14}_6C}\) klesat podle exponenciálního zákona jaderné přeměny, zatímco obsah stabilního izotopu \(\ce{^{12}_6C}\) zůstává konstantní.
Radioaktivní značení
Radioaktivní značení sledovaných objektů (umožní měření výšky hladiny kapalin v neprůhledných uzavřených nádobách, značkování drobného hmyzu při sledování jeho pohybu, studium mechanismu chemických reakcí, značení DNA při experimentech v molekulární biologii, …).
Příklad výsledků dosažených pomocí radioaktivně značených sloučenin:
\[\ce{R\bond{-}COOH + R^{'} - ^{18}O\bond{-}H <--> RCO - ^{18}O\bond{-}R^{'} + H2O}.\]Tímto experimentem bylo zjištěno, že při esterifikaci (reakci karboxylové kyseliny s alkoholem za vzniku esteru a vody) se karboxylová kyselina chová jako báze, neboť odštěpuje skupinu OH–, zatímco alkohol se chová jako kyselina, neboť odštěpuje kation \(\ce{H+}\), přičemž zbytek jeho molekuly, tj. \(\ce{R^{´} - ^{18}O-}\) se spojuje se zbytkem karboxylové kyseliny na ester.
Radionuklidová vyšetření
Tato vyšetření řadíme do skupiny tzv. radiodiagnostických metod.
Při radionuklidovém vyšetření se sleduje rozložení vhodného radioaktivního zářiče v těle pacienta. Tento zářič (např. látky obsahující např. izotopy: \(\ce{^{99m}Tc,\ ^{18}F,\ ^{51}Cr,\ ^{59}Fe}\)) je pacientovi záměrně vpraven do těla.
Defektoskopie materiálů
Defektoskopie je metoda kontroly materiálů a výrobků prozařováním paprsky gama. Představuje jednu z nejrozsáhlejších oblastí praktického využití radioizotopů v průmyslu a je jinými prostředky nenahraditelná. Výhoda defektoskopie gama proti rentgenovému prozařování je v tom, že gama záření je pronikavější a tím je větší hloubka kontroly.
Sterilizace materiálů
Ke sterilizaci materiálů (obvazů, lékařských nástrojů, apod.) se využívá hlavně záření gama. Ionizující záření ničí choroboplodné zárodky (mikroby, plísně, kvasinky) bez nutnosti zahřívání materiálu na vysokou teplotu.
Léčení nádorových onemocnění
Léčení nádorových onemocnění se zabývá fyzikálně-medicínský obor radioterapie, který využívá biologické účinky ionizujícího záření pro léčebné účely. Zhoubné nádory se ozařují zdroji, které jsou umístěny mimo tělo pacienta a jejichž paprsky směřují k nádorovému ložisku. K záření je zpravidla více citlivá nádorová tkáň (ve stavu intenzivního buněčného dělení) než tkáň zdravá. Dostatečně vysoké dávky záření jsou tedy schopny usmrcovat nádorové buňky.







