12 Polarita vazeb
Znalost polarity vazeb v molekulách je důležitá pro posouzení chemického chování i některých fyzikálních vlastností, např. rozpustnosti látek.
12.1 Klasifikace vazeb podle polarity
Vazby dělíme podle polarity na nepolární, polární a iontové (více viz Dohoda o klasifikaci vazeb podle polárnosti).
- vazba nepolární
Elektronová hustota u nepolární vazby je ve vazebném molekulovém orbitalu (orbitalech) rozložena rovnoměrně mezi oba vázané atomy, proto nedochází ke vzniku parciálního elektrického náboje na žádném z obou vázaných atomů (Obr. 12-1).
Přesně vzato, skutečně nepolární vazba je pouze ve víceatomových molekulách tvořených jedním prvkem. Všechny ostatní kovalentní vazby jsou polární.
\(\ce{F2}\) neboli \(\ce{F-F}\)  Obr. 12‑1: Příklady nepolárních kovalentních vazeb a rozdělení elektronové hustoty vazebných elektronových párů v molekule kyslíku a molekule fluoru.
Obr. 12‑1: Příklady nepolárních kovalentních vazeb a rozdělení elektronové hustoty vazebných elektronových párů v molekule kyslíku a molekule fluoru.
Znázorněno je pouze rozložení vazebných elektronů. - vazba polární
Elektronová hustota u polární vazby je ve vazebném molekulovém orbitalu (orbitalech) posunuta blíže k jednomu (elektronegativnějšímu) z vazebných partnerů. Ten je proto částečně (parciálně) záporně nabit. Druhý atom je parciálně kladně nabit (parciální náboje viz kapitola 12.2).
\(\ce{HCl}\) neboli \(\ce{H^{\delta+} -> Cl^{\delta-}}\)  Obr. 12‑2: Příklad polární vazby a rozdělení elektronové hustoty vazebného elektronového páru v molekule \(\ce{HCl}\).
Obr. 12‑2: Příklad polární vazby a rozdělení elektronové hustoty vazebného elektronového páru v molekule \(\ce{HCl}\).Poznámka:
Rozdíl mezi rozdělením elektronové hustoty u vazby nepolární oproti vazbě polární znázorňují následující dva obrázky.
Nepolární vazba vzniklá překryvem orbitalů s (levý atom) a p (pravý atom) by měla přibližně následující rozložení elektronové hustoty:
 , zatímco polární vazba by měla větší hustotu elektronů u jednoho z vazebných partnerů, tj. nastala by jedna z těchto možností:
, zatímco polární vazba by měla větší hustotu elektronů u jednoho z vazebných partnerů, tj. nastala by jedna z těchto možností:  nebo
nebo  .
. - vazba iontová
Elektronová hustota vazebného elektronového páru (párů) je téměř (v ideálním případě úplně) přetažena k jednomu z vázaných atomů. Ten je pak nositelem záporného elektrického náboje (v ideálním případě jde o celistvý násobek elektrického náboje elektronu, reálně však nedojde k úplnému přesunutí elektronů a náboj je pak menší – viz kapitola 17), zatímco druhý atom je nositelem kladného elektrického náboje.
Podstatou iontové vazby je pak elektrostatická přitažlivá síla mezi oběma opačně nabitými ionty. Iontová vazba je na rozdíl od vazby kovalentní všesměrová: k iontu jsou přitahovány opačně nabité ionty ve všech směrech (Obr. 17-1, kapitola 17).
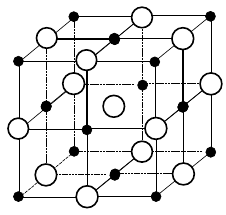 Obr. 12‑3: Iontový krystal \(\ce{NaCl}\). Schéma iontového krystalu.
Obr. 12‑3: Iontový krystal \(\ce{NaCl}\). Schéma iontového krystalu.
Bílá kulička (větší bez barevné výplně) značí chloridový anion. Černá kulička (menší s barevnou výplní) představuje sodný kation.Mezi polární a iontovou vazbou není přesná fyzikální hranice; mezi oběma vazbami se odlišuje pouze na základě pravidel daných dohodou (viz následující text). Na iontovou vazbu tedy lze nahlížet jako na zvláštní případ vazby kovalentní.
Dohoda o klasifikaci vazeb podle polarity
Vazby se podle polarity klasifikují na základě rozdílu elektronegativit vázaných atomů.
| \(\Delta\chi\lt 0,4\) | nepolární vazba |
| \(\Delta\chi\in \lt 0,4;1,7\gt\) | polární vazba |
| \(\Delta\chi\gt 1,7\) | iontová vazba |
Hranice 0,4 a 1,7 jsou jen orientační, v konkrétních případech rozhoduje chemické chovánír rlátek. Je též nutno přihlédnout ke skutečnosti, že existuje více definic elektronegativityr ra podle nich témuž prvku mohou náležet různé číselné hodnoty elektronegativity.
- rozdíl elektronegativit vázaných atomů \(\Delta\chi\lt 0,4\ldots\ldots\) nepolární vazba
Příklady nepolárních látek:
Molekuly prvků \(\left(\ce{H2, O2, F2,} \ldots\right)\) jsou zcela nepolární, \(\Delta\chi = 0\).
\(\left.\begin{array}{c} \ce{\mathbf{C-H}}\\ \ce{\chi(C)=2,5}\\ \ce{\chi(H)=2,2}\\\hline \ce{\Delta\chi=0,3} \end{array}\right\rbrace\) Uhlovodíky (látky obsahující pouze uhlík a vodík) sice obsahují slabě polární vazby \(\ce{C\bond{-}H}\), ale podle dohody (\(Δχ \lt 0,4\)) je řadíme k látkám nepolárním – např. \(\ce{CH4}\), naftalen, benzen, ! Pamatujte: Uhlovodíky jsou definitoricky určeny jako látky nepolární.
- rozdíl elektronegativit vázaných atomů \(\Delta\chi\lt 0,4; 1,7\gt\ldots\ldots\) polární vazba
Příklady polárních látek:
\(\ce{{\bf{LiH}}}\) (hydrid lithný), \(\ce{{\bf{HCl}}}\) (chlorovodík) \begin{array}{rcl} \ce{\chi(Li) & = & 0,97}\\ \ce{\chi(H) & = & 2,20}\\\hline 1,7 \lt \Delta\chi & = & 1,23 \gt 0,4 \end{array} \begin{array}{rcl} \ce{\chi(H) & = & 2,20}\\ \ce{\chi(Cl) & = & 2,80}\\\hline 1,7 \lt \Delta\chi & = & 0,60 \gt 0,4 \end{array} - rozdíl elektronegativit vázaných atomů \(\Delta\chi\gt 1,7\ldots\ldots\) iontová vazba
Příklady látek s iontovou vazbou:
\(\ce{{\bf{NaCl}}}\) (chlorid sodný), \(\ce{{\bf{LiF}}}\) (fluorid lithný) \begin{array}{rcl} \ce{\chi(Cl) & = & 2,8}\\ \ce{\chi(Na) & = & 1,0}\\\hline \Delta\chi & = & 1,8 \gt 1,7 \end{array} \begin{array}{rcl} \ce{\chi(F) & = & 4,10}\\ \ce{\chi(Li) & = & 0,97}\\\hline \Delta\chi & = & 3,13 \gt 1,7 \end{array} Z tohoto výpočtu plyne, že \(\ce{LiF}\) je polárnější než \(\ce{NaCl}\), přestože obě látky jsou shodně klasifikovány jako iontové.
12.2 Parciální elektrické náboje
Parciální elektrické náboje jsou vyjádřením míry polarity chemické vazby. Částečné (parciální) náboje přítomné na atomech v polárních molekulách se označují \(\delta +\) a \(\delta -\). Tento zápis označuje, že došlo pouze k částečnému přesunu elektronů po vazbě, ale ještě ne ke vzniku iontů. Symbol \(\delta -\) se píše ke značce záporně nabitého atomu (v místě větší elektronové hustoty). Naopak symbol \(\delta +\) se píše ke značce atomu částečně kladně nabitého, tedy v místě nižší elektronové hustoty.
Příklad:
\(\ce{H^{\delta}+\bond{-}Cl^{\delta}-}\)
12.3 Způsoby zápisu polarity vazby
Polárnost je mírou nerovnoměrnosti rozložení elektronové hustoty mezi dvojici vázaných atomů.
Polarita je údaj o tom, který atom v polární vazbě nese náboj kladný a který atom nese náboj záporný.
Pro zápis polarity vazby, tj. polohy kladného a záporného náboje, se nejčastěji používají následující tři způsoby zápisu:
| \begin{array}{lcl} \ce{Li^{\delta}+} & - & \ce{H^{\delta}-} \\ \ce{Li} & \blacktriangleleft & \ce{H} \\ \ce{Li} & \rightarrow & \ce{H} \end{array} |
\(\delta +\), \(\delta -\) jsou parciální elektrické náboje na jednotlivých atomech – viz výše základna trojúhelníka je v místě větší elektronové hustoty šipka směřuje do místa, kam se ve vazbě posouvají elektrony (tj. k místu s větší elektronovou hustotou). |
12.4 Elektronové efekty
Polarita jedné vazby může ve složitějších molekulách vyvolat posun elektronových párů (polarizaci) i u vazeb sousedních. Podle toho, zda dochází k posunu \(\sigma\)-nebo \(\pi\)-elektronů, odlišujeme elektronový efekt indukční (posun \(\sigma\)-elektronů) a mezomerní (posun \(\pi\)-elektronů). Každý z nich pak podle směru posunu elektronů může být kladný (skupina vyvolávající efekt do zbytku molekuly dodává elektrony) nebo záporný (skupina vyvolávající efekt ze zbytku molekuly odebírá elektrony).
Pro označení elektronových efektů se používají následující zkratky:
| \(\ce{-I}\) | záporný indukční efekt |
| \(\ce{+I}\) | kladný indukční efekt |
| \(\ce{-M}\) | záporný mezomerní efekt |
| \(\ce{+M}\) | kladný mezomerní efekt |
- indukční elektronový efekt
- kladný indukční efekt (+I-efekt)
Skupina vyvolávající +I-efekt dodává do zbytku molekuly \(\sigma\)-elektrony.
Mezi atomy a skupiny vyvolávající +I-efekt patří např. Mg a alkylové skupiny.
Příklad:


 S rostoucí vzdáleností od skupiny vyvolávající efekt klesá velikost tohoto efektu (platí pro všechny elektronové efekty).
S rostoucí vzdáleností od skupiny vyvolávající efekt klesá velikost tohoto efektu (platí pro všechny elektronové efekty). - záporný indukční efekt (–I-efekt)
Skupina vyvolávající –I-efekt ze zbytku molekuly odčerpává \(\sigma\) elektrony.
Mezi skupiny vyvolávající -I-efekt patří např. \(\ce{-Br}\), \(\ce{-Cl}\), \(\ce{-I}\), \(\ce{-OH}\) (hydroxoskupina), \(\ce{-NH2}\) (aminoskupina).
Příklad –I-efektu:

Příklad uplatnění záporného indukčního efektu:
Ovlivnění síly kyseliny velikostí indukčního efektu.
- kladný indukční efekt (+I-efekt)
- mezomerní elektronový efekt (konjugační)
- kladný mezomerní efekt
Skupina vyvolávající +M-efekt poskytuje \(\pi\)-elektrony do konjugace.
Kladný mezomerní efekt vyvolávají skupiny, které se na zbytek molekuly váží jednoduchou vazbou a k dispozici mají nevazebné elektronové páry, např.:

Nevazebný elektronový pár vyvolávající skupiny se snaží zapojit do konjugace, řád vazby skupiny ke zbytku molekuly tím roste.
Příklady posunu \(\pi\)-elektronů při +M-efektu:

- záporný mezomerní efekt (–M-efekt)
Skupina vyvolávající –M-efekt odčerpává \(\pi\)-elektrony ze zbytku molekuly. Vyvolávající skupina obsahuje na konci molekuly násobnou vazbu. Elektrony z této vazby se posouvají na místo nevazebných elektronů a řád vazby vyvolávající skupiny ke zbytku molekuly klesá.
Záporný mezomerní efekt vyvolávají např. skupiny:
\(\ce{-C#N}\) (kyanoskupina), \(\ce{-COOH}\) (karboxylová skupina), \(\ce{-COOR}\) (esterová skupina), \(\ce{-CHO}\) (aldehydová skupina), \(\ce{-NO2}\) (nitroskupina)
Příklady posunu \(\pi\)-elektronů při -M-efektu:
látka posun \(\pi\)-elektronů výsledné rozložení elektronové hustoty  benzonitril
benzonitril



 benzoová kyselina
benzoová kyselina



 vinylaldehyd
vinylaldehyd



 nitroethen
nitroethen



- kladný mezomerní efekt
Vliv I- a M-efektu na průběh elektrofilní substituce
Porozumění I- a M-efektu je důležité např. pro odhad reaktivity organických sloučenin. Při elektrofilní substituci už jednou substituovaného benzenu mají indukční a mezomerní efekt vliv na místo, kam se naváže další substituent na jádro.
Nejprve si připomeneme označení poloh substituentů na benzenovém jádře. Je zřejmé z následujícího obrázku:
 |
|
Ovlivnění elektrofilní substituce
-
Substituenty vykazující vůči jádru kladný mezomerní efekt řídí vstup dalšího substituentu přednostně do poloh ortho– a para–. Tyto substituenty se nazývají substituenty 1. třídy a obecně usnadňují vstup dalšího elektrofilního substituentu na jádro.
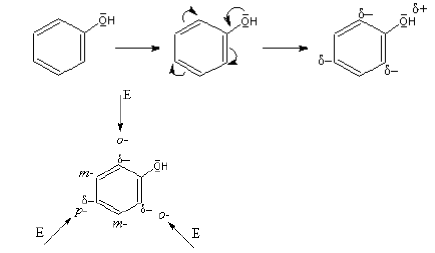 Obr. 12‑4: Grafické znázornění vlivu substituentů 1. třídy na substituci elektrofilní. E \(\ldots\) elektrofil.
Obr. 12‑4: Grafické znázornění vlivu substituentů 1. třídy na substituci elektrofilní. E \(\ldots\) elektrofil.Příklady substituentů 1. třídy (= substituenty vykazující +M-efekt) \(\ce{-F, -Br, -Cl , -I, -OH, -SH, -OR, -NH2, -NHR, -NR2, -NO, -R}\)
\(\ce{R}\qquad\)značí uhlovodíkový zbytekOba efekty (indukční a mezomerní) mohou v dané molekule nastat současně a mohou se navzájem kombinovat. Podrobnější vysvětlení však již přesahuje poslání tohoto studijního materiálu.
-
Substituenty vykazující vůči jádru záporný mezomerní efekt řídí vstup dalšího substituentu přednostně do polohy meta–. Tyto substituenty se nazývají substituenty 2. třídy a obecně znesnadňují vstup dalšího elektrofilního substituentu na jádro (záporný mezomerní efekt z aromatického jádra odčerpává elektrony a tím zeslabuje vazbu elektrofilních substituentů na jádro).
 Obr. 13‑5: Grafické znázornění vlivu substituentů 2. třídy na substituci elektrofilní.
Obr. 13‑5: Grafické znázornění vlivu substituentů 2. třídy na substituci elektrofilní.Příklady substituentů 2. třídy (= substituenty vykazující –M-efekt) \(\ce{-CN, -COOH, -COOR, -SO3H,-CHO}\ \text{(aldehydová)},\ \ce{-NO2, -COR}\)
\(\ce{R}\qquad\)značí uhlovodíkový zbytek
12.5 Dipólový moment
Dipólový moment je důležitá fyzikálně chemická veličina poskytující informace o polaritě vazeb a o geometrii molekul. Dá se relativně snadno zjistit např. měřením elektrické kapacity kondenzátoru naplněného zkoumanou látkou. Jiné metody určující geometrii molekul (např. RTG difrakce) potřebují mnohem nákladnější experimentální vybavení (v ceně řádově milionů až desítek milionů korun).
Dipólový moment určuje míru polarizace vazby. Je to vektor směřující od jednoho k druhému pólu polární vazby mezi dvěma atomy. Pro dvojatomové molekuly je definován vztahem:
| \(\delta\) | parciální náboj na kladně nabitém atomu (uvádí se v jednotkách coulomb, značka \(\mathrm{C}\)) |
| \(\vec{\ell}\) | vzdálenost středů vázaných atomů (orientace viz výše) (uvádí se v metrech) |
| \(\vec{\mu}\) | dipólový moment (uvádí se v jednotkách \(\mathrm{C\,m}\), čti „Coulomb metr“; pozor, nezaměňovat se zápisem centimetrů \(\mathrm{C\,m \times cm}\)) |

Zadání:
Délka vazby \(\ce{\it H-F}\) v molekule fluorovodíku je \(\mathit{0,0917}\,nm\), dipólový moment \(HF\) je \(\mathit{6,08 \cdot 10^{-30}}\,C\ m\). Vypočítejte velikost parciálního náboje na atomu vodíku a fluoru.
Dipólový moment \(\vec{\mu}\) dvouatomové molekuly je definován vztahem (12-1): \(\vec{\mu} = \delta \cdot \vec{\ell}\), pro velikosti platí \(\mu = \delta \cdot \ell\).
Odtud vyjádříme náboj \(\delta\) a číselně dosadíme:
Vypočítané parciální náboje na atomech H a F v molekule fluorovodíku jsou \(+6,63 \cdot 10^{-20}\,\mathrm{C}\) (na atomu H) a \(-6,63 \cdot 10^{-20}\,\mathrm{C}\) (na atomu F).
Pro víceatomové molekuly je možno hodnotu dipólového momentu zjistit dvěma způsoby:
- Jedna možnost je výpočtem jako vektorový součet dipólových momentů vazeb (ty jsou uvedeny v tabulkách).
- Druhá možnost je experimentálně - měřením elektrické kapacity kondenzátoru naplněného zkoumanou látkou.
12.5.1 Souvislost polarity molekul s dipólovým momentem
Molekula je nepolární, jestliže její celkový dipólový moment je roven nule.
nepolární molekula \(\vec{\mu} = 0\)
Molekula je polární, jestliže její celkový dipólový moment je různý od nuly.
polární molekula \(\vec{\mu} \neq 0\)
Pozor, polarita molekuly není totéž jako polarita vazby. Molekula může být tvořena polárními vazbami, ale jako celek může být přesto nepolární, např. \(\ce{CCl4}\) nebo \(\ce{BF3}\).
12.5.2 Vzájemná souvislost geometrie molekul a dipólového momentu
Příklady využití dipólového momentu ve strukturní analýze:
-
\(\ce{CO2}\)…naměřeno \(\vec{\mu} = 0\), což souhlasí se znalostmi o geometrii \(\ce{CO2}\): atom \(\ce{C}\) je v molekule \(\ce{CO2}\) v hybridním stavu sp (určování hybridizace viz kap. 13) \(\Rightarrow\) molekula \(\ce{CO2}\) má lineární uspořádání:

Dipólové momenty obou vazeb \(\ce{C=O}\) jsou stejně velké, ale opačně orientované, vzájemně se proto vyruší a celkový dipólový moment molekuly \(\ce{CO2}\) je proto nulový.
\(\ce{SO2}\)…naměřeno \(\vec{\mu} \neq 0\). Toto také souvisí se znalostmi o geometrii \(\ce{SO2}\): Středový atom molekuly \(\ce{SO2}\) je atom síry a je v hybridním stavu \(\ce{sp^2}\); molekula \(\ce{SO2}\) je proto lomená:

Z obrázku je zřejmé, že vektorový součet dipólových momentů vazeb \(\ce{S=O}\) není nulový.
-
\(\ce{H2O}\)…naměřeno \(\vec{\mu} = 6,13\cdot 10^{-30}\mathrm{\,C\ m}\). Toto také souhlasí se strukturou molekuly
\(\ce{H2O}\): Středový atom je atom kyslíku a je v hybridním stavu \(\ce{sp^3}\) \(\Rightarrow\) molekula vody je lomená:
Vektorový součet dipólových momentů vazeb \(\ce{O-H}\) proto není nulový.
-
-
Následující příklad ukazuje, že pomocí dipólového momentu lze v některých případech odlišit izomery jedné látky.
řada dichlorbenzenů
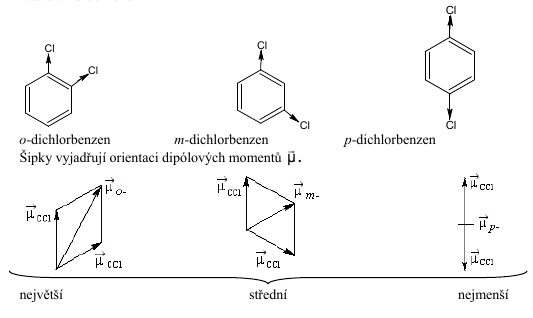 vektorový součet dipólových momentů
vektorový součet dipólových momentůexperimentální hodnoty dipólových momentů:
\[\ce{\vec{\mu}_{o-}=8,63\cdot 10^{-30}\,C\,m}\qquad\ce{\vec{\mu}_{m-}=5,57\cdot 10^{-30}\,C\,m}\qquad\ce{\vec{\mu}_{p-}=0}\]Pomocí \(\vec{\mu}\) tak lze odlišit izomery \(o-, m-, p-\).
Poznámka:
Teoreticky odhadované pořadí velikostí dipólových momentů souhlasí s experimentálními výsledky.



