9 Chemická vazba
V přírodě kolem nás se samostatné atomy vyskytují jen výjimečně (např. vzácné plyny). Atomy se většinou spojují ve větší celky, vytvářejí molekuly nebo krystaly. Pokud vytvářejí molekuly, jsou spojeny chemickou vazbou.
9.1 Definice chemické vazby
Soustava (systém) je nejstabilnější, má-li nejmenší možnou energii.
Na chemickou vazbu můžeme pohlížet dvěma způsoby. Jedním z pohledů je elektronová teorie chemické vazby, druhou možností je vlnově mechanický výklad chemické vazby.
9.2 Elektronová teorie chemické vazby
Elektronová teorie chemické vazby je založena na předpokladu, že každý atom v molekule se snaží dosáhnout elektronové konfigurace vzácného plynu, případně elektronové osmnáctky nebo dvacítky.
To se může uskutečnit:
- předáním jednoho nebo více elektronů jinému atomu (vzniká tak vazba iontová, která je všesměrová),
- společným sdílením jednoho nebo více elektronů s jiným atomem (vzniká tak vazba kovalentní, která je směrově specifická).
9.3 Vlnově mechanický výklad chemické vazby
Má-li vzniknout chemická vazba, musí se nejprve atomy přiblížit na vzdálenost interakce (to je vzdálenost, kdy na sebe začnou energeticky působit). Toto přiblížení je realizováno „srážkou“ dvou atomů. Dojde při něm k částečnému průniku jejich atomových orbitalů. Následně (za vhodných okolností) může dojít ke spojení atomových orbitalů, přičemž se uvolní energie (Obr. 9-1) a vznikne chemická vazba. Pokud není některá z podmínek splněna (průnik AO, jejich spojení, uvolnění energie), chemická vazba nevznikne.
\(\ce{r}\)… vzdálenost jader atomů
\(\ce{r0}\)… délka chemické vazby (vzdálenost jader vázaných atomů)
\(\ce{E_{d}}\)… vazebná energie (disociační energie vazby, energie vazby)
9.4 Parametry chemické vazby
Vazebná energie (energie vazby)
Je to energie uvolněná při vzniku jedné chemické vazby. Tzv. molární vazebná energie je energie, která se uvolní při vzniku \(\mathrm{ 1\,mol}\) vazeb. Molární vazebná energie mívá hodnotu řádově ve stovkách \(\mathrm{ kJ\,mol^{–1}}\). Energie uvolněná při vzniku jedné vazby je úměrně menší, a přestože je možné ji udávat v jednotkách soustavy SI (J), velmi často se udává v jednotkách eV (čti elektronvolt). Převodní vztah je \(\mathrm{ 1\,eV = 1,602 \cdot 10^{–19}\,J}\).
Disociační energie vazby
Je to energie, kterou je nutno dodat na rozštěpení jedné chemické vazby. Tzv. molární disociační energie vazby je nutná na rozštěpení \(\mathrm{ 1\,mol}\) vazeb. Je stejně velká (včetně znaménka) jako energie, která se uvolní při vzniku téže vazby (tzv. vazebná energie, energie vazby, resp. molární vazebná energie).
Délka vazby
Délka vazby se měří jako vzdálenost jader atomů, protože jádro je ve srovnání s celým atomem velmi malé, zato však těžké (v jádře je soustředěna prakticky veškerá hmotnost atomu). Proto je relativně snadno experimentálně lokalizovatelné, např. pomocí difrakce rentgenového záření na krystalu zkoumané látky.
Délky vazeb jsou řádově \(\ce{10^{–10}\,m}\). Tato vzdálenost je pro chemickou vazbu natolik charakteristická, že se pro ni dříve používala zvláštní jednotka nazývaná angström. Převodní vztah je \(\ce{1\, \AA = 1 \cdot 10^{–10}\,m}\). Dnes se již tato jednotka nemá používat.
Přesněji řečeno, veličina nazývaná délka vazby je průměrná vzdálenost jader vázaných atomů; ve skutečnosti totiž dochází k tzv. vibracím vazby (Tab. 15). Za délku vazby pak pokládáme střední neboli průměrnou hodnotu mezijaderné vzdálenosti.
| a) | 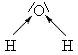 |
Obě vazby se současně zkracují a prodlužují – symetrické vibrace. |
| b) |  |
Jedna vazba se zkracuje a druhá se v témže okamžiku prodlužuje (a naopak) – antisymetrické vibrace. |
| c) |  |
Mění se vazebný úhel (jako při stříhání nůžkami) – nůžkové vibrace. |
9.5 Klasifikace chemických vazeb
Kovalentní vazba
Vazbu považujeme za kovalentní, je-li (\(\Delta \chi \lt 0,4,\text{ kde }\Delta \chi\) je rozdíl elektronegativit vázaných atomů. Je založena na společném sdílení dvojic elektronů (vazebných elektronových párů) mezi vázanými atomy. Oba elektrony jsou společné oběma atomům a mají navzájem opačný spin (podle Pauliho principu). Každý z atomů spojených kovalentní vazbou dosahuje stabilní elektronové konfigurace nebližšího vzácného plynu.
Počet \(\sigma\) vazeb (kap. 10.1) vycházejících z atomu prvku ve sloučenině se nazývá vaznost prvku.
Koordinačně-kovalentní vazba
Koordinačně kovalentní vazba je zvláštním typem vazby kovalentní. Liší se od ní pouze způsobem vzniku, zatímco vlastnosti obou druhů vazeb jsou stejné.
Koordinačně-kovalentní vazba vzniká tak, že jeden atom (= donor neboli dárce) poskytne do vazby volný elektronový pár a druhý atom (= akceptor neboli příjemce) ho přijme. Akceptorem je obvykle centrální atom, zatímco donory jsou obvykle některé elektronegativní atomy ligandů. Více o koordinačně-kovalentní vazbě viz kapitola 15.2.1.
Iontová vazba
Iontová vazba je typ chemické vazby, ve které jeden atom získá jeden nebo více elektronů na úkor druhého atomu. Vzniká, pokud rozdíl elektronegativit vázaných atomů je velký; obvykle se uvažuje, že iontová vazba vzniká při rozdílu elektronegativit \(\Delta\chi \gt 1,7\). Atomy se při vzniku iontové vazby snaží získat nebo odevzdat jeden nebo více elektronů tak, aby získaly stabilní elektronovou konfiguraci (kapitola 17.5).
Na iontovou vazbu lze obecně nahlížet jako na speciální případ vazby kovalentní. Více o iontové vazbě viz kapitola 17.
Slabé vazebné interakce
Slabé vazebné interakce můžeme rozdělit na van der Waalsovy síly a vodíkovou vazbu vodíkovým můstkem (tzv. „vodíkový můstek“ nebo „vodíková vazba“).
Podstatou vzniku van der Waalsových sil je působení stálých nebo indukovaných molekulových dipólů (viz kapitola 12.5). Tyto síly se projevují přitahováním opačných pólů molekul. Pevnost van der Waalsových sil je asi \(\mathrm{10^{–2}\,eV}\). Více o van der Waalsových silách viz kapitola 16.
Vazba vodíkovým můstkem (tzv. „vodíkový můstek“ nebo „vodíková vazba“) vzniká u molekul, které obsahují atom vodíku vázaný k silně elektro-negativnímu prvku a obsahují atomy s volným elektronovým párem \(\left(\ce{F, O, N}\right)\). Svou pevností \(\left(\ce{0,5\,eV}\right)\) tvoří vazba vodíkovým můstkem zhruba střed mezi vazbou kovalentní \(\left(\ce{1}\text{ až }\ce{10\,eV}\right)\) a slabými vazebnými interakcemi \(\left(\ce{10^{–2}\,eV}\right)\). Více o vodíkové vazbě viz kapitola 16.2.
Kovová vazba
Kovová vazba vzniká mezi atomy kovu v tuhém stavu a je způsobena elektrostatickou přitažlivostí kationtů kovů a volně se pohybujících valenčních elektronů.
Předpokládá se tedy, že v krystalu kovu jsou pravidelně uspořádaná jádra atomů kovu (včetně elektronů tzv. core, kapitola 8) v prostorové mřížce, mezi kterými se volně pohybují valenční elektrony, tvořící tzv. elektronový plyn. Více o kovové vazbě viz kapitola 18.
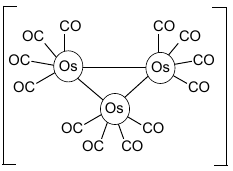
Vazba kov–kov
Vazba kov-kov je pevnější a kratší než kovová vazba, protože atomy ve vazbě kov-kov jsou k sobě blíže. Jde o směrově specifickou vazbu, která je lokalizovaná mezi dvojice atomů na rozdíl od vazby kovové, která je všesměrová. Vyskytuje se u některých koordinač-ních sloučenin (např. dodekakarbonyltriosmium), ale též u některých sloučenin d-prvků v nízkém oxidačním stavu (např. kation \(\ce{Hg_2^{2+}}\)).