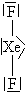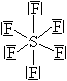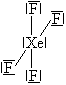13 Tvar molekul (model VSEPR, teorie hybridizace)
U víceatomových molekul neodpovídají tvary molekul a energie vazeb odhadnuté pomocí teorie molekulových orbitalů experimentálně zjištěným údajům (viz následující příklad).
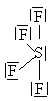
Určete tvar molekuly \(\ce{CH4}\).
- experimentálně:
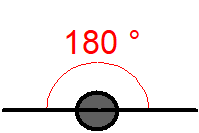
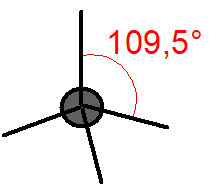
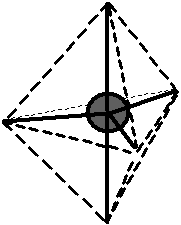
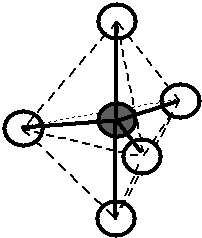
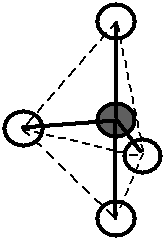
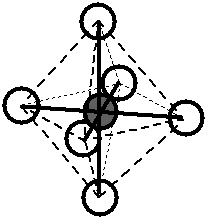
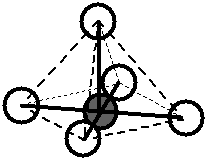
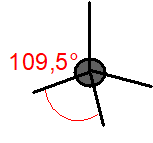
Bylo zjištěno, že molekula \(\ce{CH4}\) je zcela symetrická, tj. tvar molekuly je pravidelný tetraedr, v jehož těžišti je atom \(\ce{C}\) a ve vrcholech jsou atomy \(\ce{H}\). Úhly vazeb \(\ce{H-C-H}\) jsou stejné pro všechny vazby a mají velikost \(109,5\,^{\circ}\).. Vazebné orbitaly jsou tvarově i energeticky rovnocenné ().
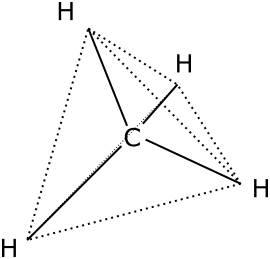 Obr. 13‑1: Tvar molekuly \(\ce{CH4}\) zjištěný experimentálně.
Obr. 13‑1: Tvar molekuly \(\ce{CH4}\) zjištěný experimentálně. - odhad pomocí teorie molekulových orbitalů:
Nejprve sestavíme elektronovou konfiguraci atomu \(\ce{H}\) a atomu \(\ce{C}\):
\begin{array}{lll} \ce{_1H}: & \ce{1\!s^1} & \BUDA \\ \ce{_6C}: & \ce{1\!s^2 2\!s^2 2\!p^2} & \BUDA\, \BUDA\, \BUA\BUA\BE \end{array}Odtud plyne, že atom uhlíku v základním stavu má jen 2 nespárované elektrony schopné tvořit kovalentní vazbu; protože v \(\ce{CH4}\) jsou čtyři vazby, nemůže být uhlík v \(\ce{CH4}\) v základním stavu. Zkusíme excitovaný stav (značí se hvězdičkou):
\begin{array}{lll} \ce{_6C^{\ast}}: & \ce{1\!s^2 2\!s^1 2\!p^3} & \BUDA\, \BUA\, \BUA\BUA\BUA\phantom{\uparrow} \end{array}V tomto excitovaném stavu má atom \(\ce{C}\) čtyři nespárované elektrony schopné tvořit kovalentní vazbu (umožňují vznik čtyř vazeb \(\ce{C-H}\)), ale nejsou rovnocenné (jeden je v orbitalu \(\ce{2\!s}\) a tři jsou v orbitalech \(\ce{2\!p}\)).
Nejprve odhadneme tvar MO vzniklých kombinací atomového orbitalu \(\ce{1\!s}\) atomů vodíku a atomového orbitalu \(\ce{2\!s}\), resp. tří atomových orbitalů \(\ce{2\!p}\) atomu uhlíku:
Význam zkratek AO, HAO, MO viz kapitola 10.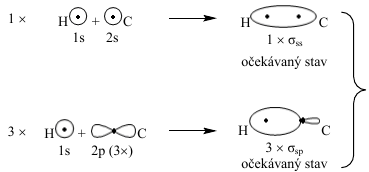
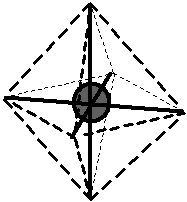
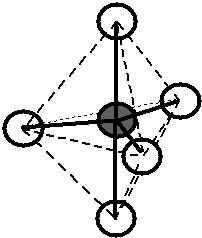
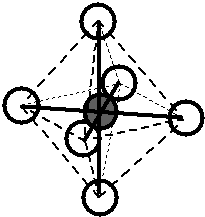
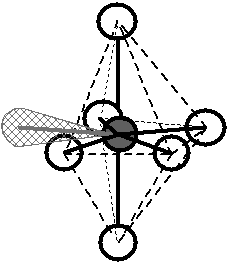
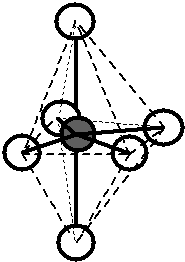
Molekulové orbitaly, vzniklé kombinací atomového orbitalu \(\ce{1\!s}\) atomu \(\ce{H}\) s jedním orbitalem \(\ce{2\!s}\) atomu uhlíku, (resp. se třemi orbitaly \(\ce{2\!p}\) atomu uhlíku) by se měly lišit (pokud nedojde k žádnému dalšímu, dosud neuvažovanému efektu) tvarem i energií. Pokud jde o prostorovou orientaci, měly by podle teorie MO být na sebe vazby \(\sigma_{sp}\) navzájem kolmé, o vazbě \(\sigma_{ss}\) nelze nic říci (Obr. 13-2 vpravo).
Pokud tvar molekuly (odhadnutý z teorie MO i zjištěný experimentálně) zakreslíme do základního tvaru krychle, získáme následující srovnání:
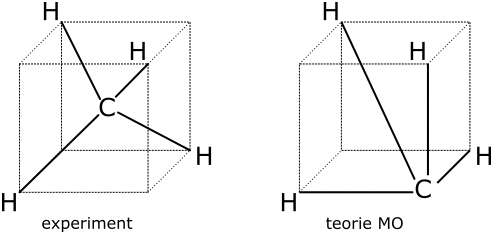 Obr. 13‑2: Srovnání skutečného tvaru molekuly \(\ce{CH4}\) a tvaru odhadnutého pomocí teorie MO.
Obr. 13‑2: Srovnání skutečného tvaru molekuly \(\ce{CH4}\) a tvaru odhadnutého pomocí teorie MO.
Vlevo: Experimentálně zjištěný (skutečný) tvar. Vpravo: Tvar plynoucí z teorie MO.
Tvar molekul, vazebné úhly a vazebné délky se stanovují experimentálně. Je také možno je předpovídat pomocí výpočtů založených na Schrödingerově rovnici. Pokud tyto výpočty jsou čistě teoretické, nazývají se ab initio metody. Pokud částečně využívají i experimentální data, jde o tzv. semiempirické metody. Zde v tomto textu se seznámíme se dvěma jednoduchými modely přibližného odhadu tvaru molekul. První z nich (model VSEPR) vychází z úvah o elektrostatických interakcích, druhý pracuje s úvahami o rozložení elektronové hustoty v orbitalech (teorie hybridizace).
„Vysvětlení“ směrově orientovaných vazeb a vazebných úhlů na základě hybridních orbitalů se udržuje mezi chemiky jako celkem běžná představa již od r. 1939, kdy vyšlo první vydání knihy Linuse Paulinga nazvané The Nature of the Chemical Bond. Model VSEPR (Valence Shell Electron Pair Repulsion) rozpracovali Gillespie a Nyholm (1957).
13.1 Model VSEPR
Model VSEPR je určen pro kovalentní sloučeniny nepřechodných prvků.
Pro odhad tvaru molekul pomocí modelu VSEPR se využívají:
- Základní pravidlo pro určení výchozího tvaru VSEPR pro danou molekulu a následné určení základního tvaru molekuly (rozdíl mezi výchozím tvarem VSEPR a základním tvarem molekuly plyne např. z Tab. 20).
- Doplňková pravidla pro odhad deformace základního tvaru.
- Zapíšeme správně elektronový strukturní vzorec uvažované molekuly.
- Určíme počet \(\bf\sigma\) vazeb vycházejících ze středového atomu (\(\ce{n_{σ}}\)) - bez ohledu na násobnost počítáme každou vazbu vždy jen jako jednu vazbu.
- Určíme počet nevazebných elektronových párů na středovém atomu (\(\ce{n_{n}}\)).
- Podle hodnoty součtu \(\ce{n_{tot} = n_{σ} + n_{n}}\) určíme výchozí tvar VSEPR pro danou molekulu (Tab. 19).
- Pro určení základního tvaru molekuly do výchozího tvaru VSEPR osadíme kolem středového atomu jádra atomů, které jsou na něj vázány a nevazebné (volné) elektronové páry středového atomu. Nevazebné elektronové páry vstupují u výchozího tvartu VSEPR „trigonální bipyramida“ vždy přednostně do pozic v ekvatoriální (vodorovné) rovině. U výchozího tvaru „oktaedr“ se umísťují tak, aby byly co nejdále od sebe a aby se proto co nejméně elektrostaticky odpuzovaly. Nevazebné (volné) elektronové páry se běžnými experimentálními metodami nezobrazují, proto se název základního tvaru molekul vyvozuje pouze z poloh atomů.
- Deformacemi základního tvaru molekul se zabývají doplňková pravidla.
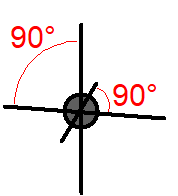
 středový atom,
středový atom,  \(\bf\sigma\)-vazby a volné elektronové páry na středovém atomu. Čárkovaně jsou vyznačeny pomyslné hranice výchozího tvaru VSEPR.
\(\bf\sigma\)-vazby a volné elektronové páry na středovém atomu. Čárkovaně jsou vyznačeny pomyslné hranice výchozího tvaru VSEPR.
 středový atom,
středový atom,  ostatní atomy,
ostatní atomy, 
| Příklad látky | \(\ce{n_{\sigma}}\) | \(\ce{n_{n}}\) | \(\ce{n_{tot}=n_{\sigma} + n_{n}}\) | Tvar molekuly | ||||
|---|---|---|---|---|---|---|---|---|
| Molekulový vzorec | Elektronový strukturní vzorec | Výchozí tvar VSEPR | Poloha jader atomů a nevazebných elektronových párů středového atomu | Část molekuly „viditelná“ experimentálně | Název základního tvaru molekuly | |||
| \(\ce{CO2}\) | 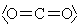 |
2 | 0 | 2 |  |
 |
 |
Lineární |
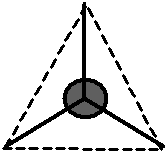
| \(\ce{BF3}\) | 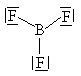 |
3 | 0 | 3 |  |
 |
 |
Rovnostranný trojúhelník |
| \(\ce{SO2}\) | 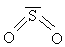 |
2 | 1 | 3 |  |
 |
Lomená | |
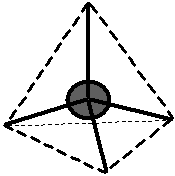
| \(\ce{CH4}\) | 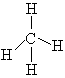 |
4 | 0 | 4 |  |
 |
 |
Pravidelný tetreaedr |
| \(\ce{NH3}\) | 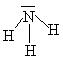 |
3 | 1 | 4 |  |
 |
Trigonální pyramida (tetraedr) | |
| \(\ce{H2O}\) | 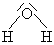 |
2 | 2 | 4 |  |
 |
Lomená | |
 středový atom,
středový atom,  ostatní atomy,
ostatní atomy, 
 středový atom,
středový atom,  ostatní atomy,
ostatní atomy, 
- Nevazebný elektronový pár n odpuzuje ostatní elektronové páry více než vazebný pár \(\ce{\sigma}\).
- U dvojné a trojné vazby jsou elektronové páry \(\ce{\sigma}\) provázeny elektronovými páry \(\ce{\pi}\). Vzniklá dvojice \(\ce{\sigma + \pi}\) nebo trojice \(\ce{\sigma + 2\pi}\) odpuzuje ostatní elektronové páry více než samotný pár \(\ce{\sigma}\).
- Odpuzování vazebných elektronových párů závisí také na rozdílech v elektronegativitě vazebných partnerů.
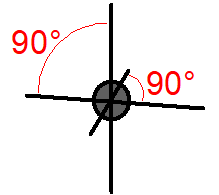
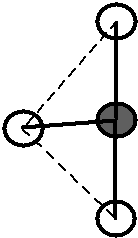
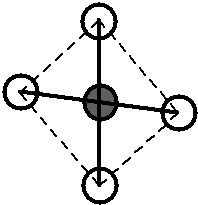
Určete tvar molekuly vody.
Vzorec vody je \(\ce{H2O}\).
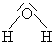
Středový atom je atom kyslíku O.
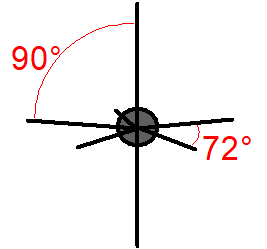
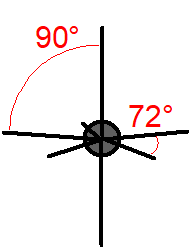
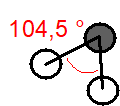
\begin{array}{lcl} n_\sigma & = & 2\ \text{(z atomu O vycházejí dvě \(\ce{σ}\)-vazby)} \\ n_n & = & 2\ \text{(na atomu O jsou dva nevazebné elektronové páry).} \\ \\ n_\text{tot} & = & n_\sigma + n_n = 2 + 2 = 4 \end{array}Výchozí tvar VSEPR pro molekulu vody je pravidelný tetraedr, kde vazebné úhly jsou \(\ce{109,5\,^{\circ}}\). Podle toho by úhel \(\ce{H-O-H}\) v molekule vody měl být také \(\ce{109,5\,^{\circ}}\). Ale protože na atomu O jsou dva nevazebné elektronové páry, které od sebe zbytek molekuly odpuzují (doplňkové pravidlo č. 1), je úhel \(\ce{H-O-H}\) menší, než je odhadnuto z výchozího tvaru VSEPR. Experimentálně bylo zjištěno, že úhel \(\ce{H-O-H}\) v molekule vody má velikost \(\ce{104,5\,^{\circ}}\)(Obr. 13-3).
| Výchozí tvar VSEPR | Základní tvar molekuly | Deformace | Tvar molekuly zjištěný experimentálně | |||
 |
\(\rightarrow\) | 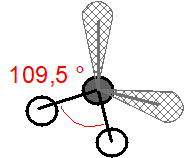 |
\(\rightarrow\) | 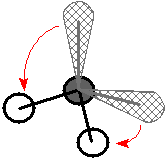 |
 |
|
| pravidelný tetraedr | lomená molekula, \(\ce{\alpha = 109,5\,^{\circ}}\) | lomená molekula, \(\ce{\alpha \lt 109,5\,^{\circ}}\) | lomená molekula, \(\ce{\alpha = 104,5\,^{\circ}}\) |
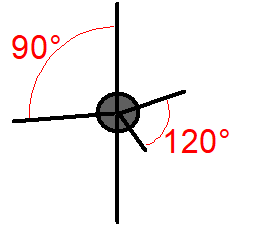
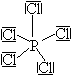
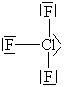
Určete tvar molekuly fosgenu.
Vzorec fosgenu je \(\ce{COCl2}\) (fosgen = dichlorid kyseliny uhličité = dichloridoxid uhličitý = dichlorid karbonylu).
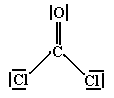
Středový atom je atom uhlíku C.
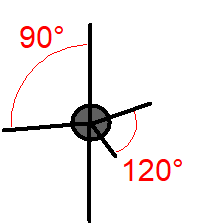
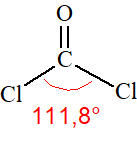
\begin{array}{lcl} n_\sigma & = & 3\ \text{(z atomu C vycházejí tři \(\ce{σ}\)-vazby)} \\ n_n & = & 0\ \text{(na atomu C nejsou žádné nevazebné elektronové páry).} \\ \\ n_\text{tot} & = & n_\sigma + n_n = 3 + 0 = 3 \end{array}Z toho vyplývá, že výchozí tvar VSEPR pro molekulu fosgenu je rovnostranný trojúhelník, pro který úhel sevřený spojnicemi těžiště s vrcholy je roven \(\ce{120\,^{\circ}}\). Podle toho by úhel \(\ce{Cl–C–Cl}\) v molekule fosgenu měl být také \(\ce{120\,^{\circ}}\). Ale protože kyslík má větší elektronegativitu než chlor, bude větší elektronová hustota na kyslíku. Ten pak „zabere víc místa“. Proto atom kyslíku více odpuzuje sousední atomy, než je odpuzují atomy chloru (aplikace doplňkového pravidla č. 3). Dále aplikujeme pravidlo č. 2, které říká, že dvojice \(\ce{σ + π}\) odpuzuje elektronové páry více než samotný pár σ. Proto úhel \(\ce{Cl–C–Cl}\) je menší než je odhadnuto ze základního tvaru. Experimentálně bylo zjištěno, že má velikost \(\ce{111,3\,^{\circ}}\) (Obr. 13-4).
| Výchozí tvar VSEPR | Základní tvar molekuly | Deformace | Tvar molekuly zjištěný experimentálně | |||
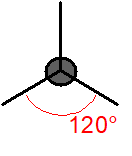 |
\(\rightarrow\) | 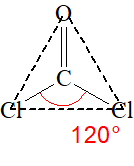 |
\(\rightarrow\) | 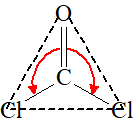 |
 |
|
| rovnostranný trojúhelník | rovnoramenný (ale ne rovnostranný) trojúhelník, \(\ce{\alpha \lt 120\,^{\circ}}\) | rovnoramenný (ale ne rovnostranný) trojúhelník, \(\ce{\alpha = 111,8^{\circ}}\) |
13.2 Teorie hybridizace
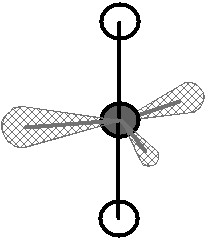
Hybridizací se rozumí energetické i tvarové sjednocení energeticky různých orbitalů daného atomu, přičemž vznikají nové orbitaly, tzv. orbitaly hybridní. Hybridizace vysvětluje vznik rovnocenných kovalentních vazeb z energeticky rozdílných orbitalů a umožňuje předpovědět strukturu takto vzniklých látek. Pro každý typ hybridizace je charakteristické rozmístění hybridních orbitalů v prostoru, což určuje i prostorové uspořádání chemických vazeb.
Pravidla hybridizace
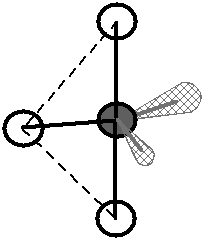
Chování elektronu v atomu vystihují nejen AO získané řešením Schrödingerovy rovnice, ale i jejich lineární kombinace. AO získané lineární kombinací původních AO nazýváme hybridizované AO a označujeme je HAO. Kombinují se AO na jednom atomu. Je třeba odlišit: pro vznik molekulových orbitalů se kombinují AO ze dvou atomů (Obr. 13-5), ale u hybridizace se kombinují AO z jednoho atomu (Obr. 13-6).
Obr. 13-5: Kombinace AO dvou atomů za vzniku MO jedné vazby.Obr. 13-6: Kombinace čtyř AO atomu uhlíku za vzniku čtveřice HAO tohoto atomu.- Počet vzniklých HAO je roven počtu kombinovaných AO (Obr. 13-6).
- Pro hybridizaci lze použít jen ty AO, které mají nepříliš rozdílnou energii (kombinují se AO, které jsou v rámečkovém diagramu na řádcích vedle sebe nebo bezprostředně nad sebou).
- Prostorová orientace HAO je jiná než prostorová orientace původních AO.
- Teprve HAO se kombinují s AO jiných atomů za vzniku vazeb (Obr. 13-7)
Pro vazby \(\ce{C-H}\) v molekule methanu by to bylo:
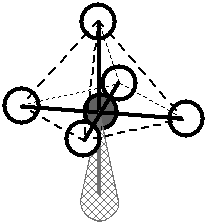
Obr. 13-7: Příklad kombinace HAO s AO za vzniku vazeb \(\ce{C-H}\) v molekule methanu. - V hybridních orbitalech mohou být umístěny jak vazebné, tak i nevazebné elektronové páry.
Obr. 13-8: Vznik dvojice hybridních orbitalů \(sp\) kombinací jednoho orbitalu s a jednoho orbitalu \(p\).
Hybridizované orbitaly mají tvar znázorněný na Obr. 13-9. Jejich počet se určí stejně, jak bylo uvedeno v bodech 1-4 kapitoly 13.1. Jejich prostorová orientace (viz Tab. 23) je analogická jako u výchozích tvarů modelu VSEPR (Tab. 19).