24 Koligativní vlastnosti
Vlastnosti zředěných roztoků, které závisí na počtu přítomných molekul rozpuštěné netěkavé látky, ale ne na jejich druhu, se označují jako vlastnosti koligativní (z latinského colligatus – svázaný, pevně spojený dohromady: „co“ = dohromady, „ligo“ = vázat). Všechny tyto vlastnosti lze uvést do souvislosti se snížením tenze páry nad hladinou roztoku látky ve srovnání s čistým rozpouštědlem. Příčinou je skutečnost, že rozpuštěná netěkavá látka nepřispívá k celkové tenzi par. Její přítomností v roztoku však klesá koncentrace rozpouštědla (a proto i tenze par rozpouštědla). Proto klesá i celková tenze par celého roztoku. Důsledkem této skutečnosti je zvýšení bodu varu a snížení bodu tuhnutí roztoku ve srovnání s čistým rozpouštědlem. Následující vztahy vycházejí z Raoultova zákona (kap. 20.2.1), příslušné výpočty přesahují poslání tohoto studijního materiálu budou probrány v rámci fyzikální chemie. Další koligativní vlastností je vznik osmotického tlaku.
24.1 Ebulioskopický efekt
Čistá voda má při normálním tlaku teplotu varu \(\mathrm{100\,^{\circ}C}\), ale \(\mathrm{10\%}\) roztok sacharózy ve vodě má teplotu varu \(\mathrm{100,17\,^{\circ}C}\). Teplota varu roztoku se tedy zvýšila o \(\mathrm{0,17\,^{\circ}C}\) oproti teplotě varu čistého rozpouštědla.
Ebulioskopie je metoda, která se používá ke stanovení molární hmotnosti rozpuštěné látky na základě měření velikosti ebulioskopického efektu. Pro velikost ebulioskopického efektu platí vztah:
| \(\mathrm{T_v}\) | teplota varu roztoku |
| \(\mathrm{T_v^*}\) | teplota varu čistého rozpouštědla |
| \(\mathrm{K_E}\) | ebulioskopická konstanta |
| \(\mathrm{c_M}\) | molální koncentrace rozpuštěné látky (molalita) |
Definice molální koncentrace (molalita) je uvedena v kapitole 4.
Hodnota ebulioskopické konstanty závisí na druhu (vlastnostech) rozpouštědla. Např. ebulioskopická konstanta \(\mathrm{K_E}\) vody má hodnotu \(\mathrm{0,513\,K\,kg\,mol^{-1}}\), benzenu \(\mathrm{2,63\,K\,kg\,mol^{-1}}\). Hodnoty \(\mathrm{K_E}\) rozpouštědel jsou uvedeny v tabulkách.
24.2 Kryoskopický efekt
Čistá voda má při normálním tlaku teplotu tuhnutí \(\mathrm{0\,^{\circ}C}\), ale \(\mathrm{10\%}\) roztok sacharózy ve vodě má teplotu tuhnutí \(\mathrm{-0,60\,^{\circ}C}\). Teplota tuhnutí roztoku se tedy snížila o \(\mathrm{0,60\,^{\circ}C}\) oproti teplotě tuhnutí čistého rozpouštědla.
Kryoskopie je metoda, která se používá ke stanovení molární hmotnosti rozpuštěné látky na základě měření velikosti kryoskopického efektu. Pro velikost kryoskopického efektu platí vztah:
| \(\mathrm{T_t^*}\) | teplota tuhnutí čistého rozpouštědla |
| \(\mathrm{T_t}\) | teplota tuhnutí roztoku |
| \(\mathrm{K_K}\) | kryoskopická konstanta |
| \(\mathrm{c_M}\) | molální koncentrace rozpuštěné látky (molalita) |
Hodnota kryoskopické konstanty závisí na druhu rozpouštědla. Např. kryoskopická konstanta \(\mathrm{K_K}\) vody má hodnotu \(\mathrm{1,86\,K\,kg\,mol^{-1}}\), benzenu \(\mathrm{5,12\,K\,kg\,mol^{-1}}\).
Srovnání ebulioskopie a kryoskopie z hlediska praktického využití
Kryoskopie je obvykle citlivější metoda než ebulioskopie, protože téměř pro všechna rozpouštědla je \(\mathrm{K_K \gt K_E}\). Na rozdíl od ebulioskopie je kryoskopie téměř nezávislá na změnách atmosférického tlaku. Při použití ebulioskopie hrozí větší nebezpečí tepelného poškození rozpuštěné látky nebo její chemické reakce s rozpouštědlem.
Ze zdravotního hlediska je také vhodnější metodou kryoskopie, protože ebulioskopie obvykle vyžaduje zahřívání rozpouštědla, při kterém mohou unikat zdraví škodlivé výpary. Z výše uvedeného plyne, že lze-li, volíme raději kryoskopii než ebulioskopii. K nevýhodám kryoskopie patří složitější a dražší technické vybavení pro měření.
Kryoskopii je možno použít pouze tehdy, když molekuly rozpuštěné látky nevytvoří s rozpouštědlem směsné krystaly a je-li roztok dostatečně zředěný.
24.3 Osmotický tlak
Jestliže oddělíme roztok od rozpouštědla polopropustnou membránou (která propouští malé molekuly rozpouštědla, ale ne velké molekuly rozpuštěné látky), bude rozpouštědlo samovolně vnikat do roztoku a zřeďovat ho. Tento jev se nazývá osmóza. Soustava se snaží dosáhnout stavu, kdy na obou stranách membrány bude stejná koncentrace rozpuštěné látky. To však není možné úplně, protože ze strany roztoku působí určitý tlak (v tomto případě hydrostatický tlak vodního sloupce o výšce h).
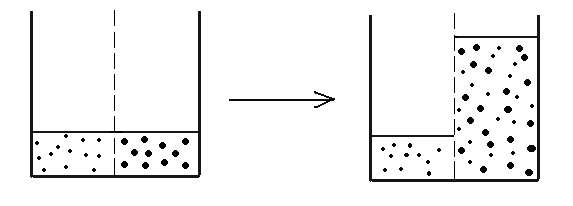
Malé tečky znázorňují molekuly rozpouštědla, velké tečky molekuly rozpuštěné látky.
Pro výpočet velikosti osmotického tlaku platí Van't Hoffova rovnice:
\(\MR{\quad p\,V = n\,R\,T, \text{úpravou (dělíme}\,V\text{)}\\\quad p=\dfrac{n}{V}R\,T, \text{dosadíme}\ c =\dfrac{n}{V}, \text{odtud}\\\quad p = c\,R\,T.}\)
Formálně místo \(\mathrm{p}\) (tlak plynu) dosadíme \(\mathrm{\Pi}\) (osmotický tlak) a dostaneme
\(\mathrm{\quad \Pi = c\,R\,T}\), což je Van't Hoffova rovnice.
| \(\mathrm{\Pi}\) | osmotický tlak |
| \(\mathrm{c}\) | látková koncentrace rozpuštěné látky |
| \(\mathrm{R}\) | molární plynová konstanta |
| \(\mathrm{T}\) | termodynamická teplota |
Metoda měření osmotického tlaku používaná ke stanovení molární hmotnosti rozpuštěných látek se nazývá osmometrie.