22 Chemická rovnováha
22.1 Ustalování rovnováhy, rovnovážný stav, ustálený stav
Pokud se nemění makroskopické měřitelné vlastnosti soustavy (tlak, teplota, chemické složení apod.), říkáme, že soustava je v rovnovážném stavu. Neznamená to ovšem, že by v soustavě nenastávaly žádné změny. Vlastnosti soustavy se mění vždy, ale v rovnováze jsou tyto změny tak malé a rychlé, že běžnou měřicí technikou nejsou pozorovatelné. O chemické rovnováze mluvíme tehdy, pokud teoreticky připadá v úvahu, že by v soustavě daného chemického složení mohlo docházet za určitých podmínek k chemické reakci, avšak tato reakce právě neprobíhá pozorovatelnou měrou.
Pokud budou v systému probíhat děje vratné, pak při rovnováze běží reakce oběma směry stejnou rychlostí. Z tohoto faktu lze při znalosti základů chemické kinetiky vyvodit vztah pro rovnovážnou konstantu (viz vztahy (22-2) – (22-5)).
Vratné reakce jsou charakterizované tím, že současně s danou reakcí probíhá i reakce zpětná, přičemž je možné přímou i zpětnou reakci v pozorovatelné míře vyvolat záměrně.
Např.\[\ce{NH3 + HCl <=> NH4Cl}\]
Umístíme-li blízko sebe chomáče vaty napuštěné roztoky \(\ce{NH3}\) a \(\ce{HCl}\), jejich výpary se smíchají, vzájemně
zreagují a vznikne \(\ce{NH4Cl (s)}\). Naopak zahříváme-li \(\ce{NH4Cl}\), dojde k jeho termálnímu rozkladu a vznikne opět
\(\ce{NH3 (g)}\) a \(\ce{HCl (g)}\).
Stručný zápis:
\[\ce{NH3 + HCl <=> NH4 Cl}\]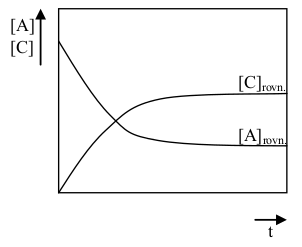
Podmínky pro ustálení chemické rovnováhy jsou:
- reakce musí být vratná
- za časovou jednotku při chemické rovnováze vzniká právě tolik produktů, jako se jich za stejnou dobu rozpadá.
Ustálený stav
V některých otevřených soustavách (chemických, fyzikálních a zejména biologických) se může ustavit ustálený stav, tj. takový, v němž se složení soustavy nemění, avšak tento stav je udržován neustálým přísunem energie z okolí. Ustálený stav je nutno od rovnovážného stavu odlišovat.
22.1.1 Guldbergův-Waageův zákon
Roku 1863 vyslovili C. M. Guldberg a P. Waage zákon o „aktivním působení hmoty“. Zákon vychází z představy o dynamické povaze chemických rovnováh a je znám také jako Guldbergův-Waageův zákon o působení aktivní hmoty:
Pod pojmem „aktivní hmota“ rozuměli Guldberg a Waage množství reaktantů v jednotce objemové, tj. jejich koncentraci.
Z tohoto zákona byl následně odvozen výraz pro tzv. rovnovážnou konstantu. Pro zavedení rovnovážné konstanty zapíšeme vratnou chemickou reakci obecně:
| \(\ce{A,B,C,D}\) |
symboly chemických látek
\(\ce{A, B}\) – výchozí látky neboli reaktanty \(\ce{C, D}\) – produkty |
| \(\ce{\alpha ,\beta ,\gamma ,\delta}\) | stechiometrické koeficienty |
Definice rovnovážné konstanty
Obecně je v čitateli výrazu pro rovnovážnou konstantu součin údajů o koncentraci (aktivitě) produktů umocněných na příslušné stechiometrické koeficienty. Ve jmenovateli je součin údajů o koncentraci (aktivitě) reaktantů umocněných na příslušné stechiometrické koeficienty.
Je-li rovnovážná konstanta větší než 1, je rovnováha reakce posunuta doprava, tj. k produktům. Je-li rovnovážná konstanta menší než 1, je rovnováha reakce posunuta doleva, tj. k reaktantům.
Rovnovážnou konstantu lze definovat pomocí:
- tlaků
\(K_p=\dfrac{p_C^\gamma p_D^\delta}{p_A^\alpha p_B^\beta}\tag{22-2}\)
\(K_p\) rovnovážná konstanta vyjádřená pomocí tlaků \(p_i\) tlak i-té látky; dolní index označuje chemickou látku, horní index je odpovídající stechiometrický koeficient – viz (22-1) - látkových koncentrací
\(K_c=\dfrac{[C]^\gamma [D]^\delta}{[A]^\alpha [B]^\beta}\tag{22-3}\)
\(K_c\) rovnovážná konstanta vyjádřená pomocí látkových koncentrací \([A]\) skutečná (nikoli analytická) rovnovážná látková koncentrace látky; písmeno v závorce označuje chemickou látku, horní index odpovídající stechiometrický koeficient – viz (22-1) - aktivit
\(K_a=\dfrac{a_C^\gamma a_D^\delta}{a_A^\alpha a_B^\beta}\tag{22-4}\)
\(K_a\) rovnovážná konstanta vyjádřená pomocí aktivit \(a_i\) aktivita i-té látky; dolní index označuje chemickou látku, horní index je odpovídající stechiometrický koeficient – viz (22-1) - molárních zlomků
\(K_x=\dfrac{x_C^\gamma x_D^\delta}{x_A^\alpha x_B^\beta}\tag{22-5}\)
\(K_x\) rovnovážná konstanta vyjádřená pomocí molárních zlomků \(x_i\) molární zlomek i-té látky; dolní index označuje chemickou látku, horní index je odpovídající stechiometrický koeficient – viz (22-1)
Rovnovážná konstanta se obvykle udává jako bezrozměrné číslo, přestože \(\mathrm{K_p}\) a \(\mathrm{K_c}\) se počítají pomocí veličin, které bezrozměrné nejsou. Obvykle se tlak \(\mathrm{p}\) udává v jednotkách \(\mathrm{Pa}\) a látková koncentrace \(\mathrm{c}\) v jednotkách \(\mathrm{mol\,dm^{–3}}\).
a) skutečný tlak \(\mathrm{p}\) (obvykle se udává v jednotkách \(\mathrm{Pa}\))
b) relativní tlak \(\mathrm{p_r}\) ( \(\mathrm{p_r=\dfrac{p}{p_{st}}, p_{st}}\) … standardní tlak, \(\mathrm{p_r}\) ... bezrozměrná veličina)
c) bezrozměrný tlak \(\mathrm{p^\circ}\) ( \(\mathrm{p^\circ=\dfrac{p}{p_{1}}, p_{1}}\) … jednotkový tlak)
Van't Hoffova reakční izoterma
Chemickou rovnováhu z termodynamického hlediska kvantitativně popisuje tzv. van't Hoffova reakční izoterma:
| \(\Delta G_r^\circ\) | reakční Gibbsova energie za standardních podmínek |
| \(R\) | molární plynová konstanta |
| \(T\) | termodynamická teplota |
| \(K_a\) | rovnovážná konstanta vyjádřená pomocí aktivit |
Poznámka:
Rovnovážnou konstantu vyjádřenou pomocí aktivit \(\mathrm{K_a}\) obvykle nahrazujeme vyjádřením pomocí skutečných rovnovážných látkových koncentrací \(\mathrm{K_c}\) . Je to sice méně přesné, ale podstatně snadnější pro výpočty.
22.1.2 Aktivita iontů v roztoku
V termodynamických vztazích popisujících vlastnosti roztoků (zejména elektrolytů) je přesnější použít místo skutečné látkové koncentrace tzv. aktivitu:
| \(a_i\) | aktivita i-tého druhu iontů (bezrozměrné číslo) |
| \(\left[X_i\right]\) | skutečná látková koncentrace i-tého druhu iontů |
| \(\gamma_i\) | aktivitní koeficient i-tého druhu iontů |
Aktivitní koeficienty se pro každý z druhů iontů přítomných v roztoku vypočítají zvlášť podle Debye-Hűckelova zákona, jehož zjednodušená (limitní) verze má tvar:
| \(A\) | tabelovaná konstanta, pro vodné roztoky je rovna přibližně \(\mathrm{0,5\,mol^{-\frac{1}{2}}\,dm^\frac{3}{2}}\) |
| \(z_i\) | nábojové číslo zvoleného druhu iontů (např. \(\mathrm{z_{Na^+}=1, z_{SO_4^{2}-}=-2, z_{Cl^-}=-1}\), apod.) |
| \(I\) | iontová síla roztoku |
Iontová síla roztoku se vypočítá podle vztahu:
| \(I\) | iontová síla roztoku |
| \(\left[X_i\right]\) | skutečná látková koncentrace i-tého druhu iontů |
| \(z_i\) | nábojové číslo zvoleného druhu iontů |
Zadání:
Vypočítejte aktivitu iontů \(\ce{Na+}\) a aktivitu iontů \(\ce{SO_4^{2}-}\) v roztoku \(\ce{Na2SO4}\) o koncentraci \(\mathrm{0,1\,mol\,dm^{–3}}\) .
- Napíšeme rovnici elektrolytické disociace všech silných elektrolytů přítomných v roztoku (vodu a slabé elektrolyty obvykle neuvažujeme): \[\ce{Na2SO4 -> 2Na+ + SO4^{2}-}\]
- Připravíme si tabulku, kterou následně vyplníme a sečteme hodnoty výrazů \(\ce{[X_{i}] z_{i}^2}\):
\(\mathrm{\displaystyle\sum_i\left(\left[X_i\right] z_i^2\right) = 0,2 + 0,4 = 0,6\,mol\,dm^{–3}}\)\(\ce{Na+}\) \(\ce{SO4^{2}-}\) \(\mathrm{[X_i] (mol\,dm^{-3})}\) \(2 · 0,1 = 0,2\) \(0,1\) \(\mathrm{z_i}\) \(1\) \(–2\) \(\mathrm{z_i^2}\) \(1\) \(4\) \(\mathrm{[X_i] z_i^2}\) \(0,2 · 1 = 0,2\) \(0,1 · 4 = 0,4\) - Vypočítáme iontovou sílu podle (22-9) \(\mathrm{I=\dfrac{1}{2}\displaystyle\sum_i\left(\left[X_i\right]z_i^2\right)=\dfrac{1}{2}\cdot 0,6=0,3\,mol\,dm^{-3}}\)
- Vypočítáme aktivitní koeficienty \(\ce{Na+}\) a \(\ce{SO4^{2}-}\) podle (22-8)
\(\ce{Na+ :}\) \(\mathrm{-\log\gamma_{Na^{+}}=Az_{Na^{+}}^2\sqrt{I}=0,5\cdot1^2\cdot\sqrt{0,3}=0,274\\ \underline{\gamma_{Na^{+}}}=10^{-0,274}=\underline{0,532}}\) \(\ce{SO_4^{2}- :}\) \(\mathrm{-\log\gamma_{SO_4^{2}-}=Az_{SO_4^{2}-}^2 \sqrt{I}=0,5\cdot (-2)^2\cdot\sqrt{0,3}=1,095\\ \underline{\gamma_{SO_4^{2}-}}=10^{-1,095}=\underline{0,08}}\) - Vypočítáme aktivitu \(\ce{Na+}\) a \(\ce{SO4^{2}-}\) podle (22-7)
\(\ce{Na+ :}\) \(\mathrm{\underline{a_{Na^+}}=\left[Na^+\right]\gamma_{Na^+}=0,2\cdot 0,532 = \underline{0,106}}\) \(\ce{SO_4^{2}- :}\) \(\mathrm{\underline{a_{SO_4^{2}-}}=\left[SO_4^{2}-\right]\gamma_{SO_4^{2}-}=0,1\cdot 0,08 = \underline{0,008}}\)
Zadání:
Máte roztok obsahující současně \(\ce{KCl}\) a \(\ce{K2SO4}\) o koncentracích \(\mathrm{0,01\,mol\,dm^{-3}}\) \(\ce{KCl}\) a \(\mathrm{0,1\,mol\,dm^{-3}}\) \(\ce{K2SO4}\). Vypočítejte aktivitu \(\ce{K+}\), \(\ce{Cl-}\) a \(\ce{SO4^{2}-}\) v tomto roztoku.
- Napíšeme rovnice elektrolytické disociace všech silných elektrolytů, přítomných v roztoku: \[\begin{array}{rcl} \ce{KCl} & \rightarrow & \ce{K+ + Cl-} \\ \ce{K2SO4} & \rightarrow & \ce{2K+ + SO4^{2}-} \end{array}\]
- Připravíme si tabulku, kterou následně vyplníme a sečteme hodnoty výrazů \(\ce{[X_{i}] z_{i}^2}\):
\(\mathrm{\displaystyle\sum_i\left(\left[X_i\right] z_i^2\right) = 0,21 + 0,01 + 0,4 = 0,62\,mol\,dm^{–3}}\)\(\ce{K+}\) \(\ce{Cl-}\) \(\ce{SO4^{2}-}\) \(\mathrm{[X_i] (mol\,dm^{-3})}\) \(0,01 + 2 · 0,1 = 0,21\) \(0,01\) \(0,1\) \(\mathrm{z_i}\) \(1\) \(–1\) \(–2\) \(\mathrm{z_i^2}\) \(1\) \(1\) \(4\) \(\mathrm{[X_i] z_i^2}\) \(0,21 · 1 = 0,21\) \(0,01 · 1 = 0,01\) \(0,1 · 4 = 0,4\) - Vypočítáme iontovou sílu podle (22-9) \(\mathrm{I=\dfrac{1}{2}\displaystyle\sum_i\left(\left[X_i\right]z_i^2\right)=\dfrac{1}{2}\cdot 0,62=0,31\,mol\,dm^{-3}}\)
- Vypočítáme aktivitní koeficienty \(\ce{K+}\) \(\ce{Cl-}\) a \(\ce{SO4^{2}-}\) podle (22-8)
\(\ce{K+ :}\) \(\mathrm{-\log\gamma_{K^{+}}=Az_{K^{+}}^2\sqrt{I}=0,5\cdot1^2\cdot\sqrt{0,31}=0,278\\ \underline{\gamma_{K^{+}}}=10^{-0,278}=\underline{0,527}}\) \(\ce{Cl- :}\) \(\mathrm{-\log\gamma_{Cl^{-}}=Az_{Cl^{-}}^2\sqrt{I}=0,5\cdot(-1)^2\cdot\sqrt{0,31}=0,278\\ \underline{\gamma_{Cl^{-}}}=10^{-0,278}=\underline{0,527}}\) \(\ce{SO_4^{2}- :}\) \(\mathrm{-\log\gamma_{\ce{SO4^{2}-}}=Az_{SO_4^{2}-}^2 \sqrt{I}=0,5\cdot (-2)^2\cdot\sqrt{0,31}=1,114\\ \underline{\gamma_{\ce{SO4^{2}-}}}=10^{-1,114}=\underline{0,077}}\) - Vypočítáme aktivitu \(\ce{K+}\) \(\ce{Cl-}\) a \(\ce{SO4^{2}-}\) podle (22-7)
\(\ce{K+ :}\) \(\mathrm{\underline{a_{K^+}}=\left[K^+\right]\gamma_{K^+}=0,21\cdot 0,527 = \underline{0,111}}\) \(\ce{Cl- :}\) \(\mathrm{\underline{a_{Cl^-}}=\left[Cl^+\right]\gamma_{Cl^+}=0,01\cdot 0,527 = \underline{0,00527}}\) \(\ce{SO_4^{2}- :}\) \(\mathrm{\underline{a_{SO_4^{2}-}}=\left[SO_4^{2}-\right]\gamma_{SO_4^{2}-}=0,1\cdot 0,077 = \underline{0,0077}}\)
22.2 Le Chatelierův-Braunův princip
Porušení rovnováhy vnějším zásahem (akcí) vyvolá děj (reakci), který směřuje ke zrušení účinku vnějšího zásahu (akce).
Příklady aplikace Le Chatelierova-Braunova principu:
- vliv změny množství látek v chemické reakci:
Uvažujeme vratnou reakci:
\[\ce{H2 (g) + I2 (g) <=> 2 HI (g)}\]akce: odebereme produkt (\(\ce{HI}\)) důsledek akce: produktu je méně, než odpovídá rovnováze reakce: proběhne takový děj, aby odstraněný produkt byl opět doplněn, tj. reakce zleva doprava - vliv změny tlaku:
Projeví se jen tehdy, pokud se reakce účastní alespoň jedna plynná látka (buď jako reaktant, nebo jako produkt) a pokud součet stechiometrických koeficientů u plynů na levé straně rovnice není roven součtu stechiometrických koeficientů u plynů na pravé straně rovnice. Hovoříme o tzv. změně molového čísla \(\ce{\Delta n}\).
Pak platí, že zvýšením tlaku se rovnováha posune na tu stranu, kde je menší látkové množství plynů. Naopak snížením tlaku se rovnováha posune na tu stranu, kde je větší látkové množství plynů.
Např. v reakci \(\ce{H2(g) + I2(g) <=> 2 HI(g)}\), kde látkové množství plynů vlevo je rovno látkovému množství plynů vpravo nemá změna tlaku na rovnováhu žádný vliv.Příklad:
Uvažujeme vratnou reakci:
\[\underbrace{\ce{3H2(g) + N2(g)}}_{\mathrm{4\,mol\,(g)}} \ce{<=>} \underbrace{\ce{2NH3(g)}}_{\mathrm{2\,mol\,(g)}}\]akce: zvýšíme tlak reakce: tlak musí opět klesnout, k tomu dojde při poklesu celkového látkového množství plynů v soustavě, proto děj v daném případě proběhne zleva doprava (vlevo \(\mathrm{4\,mol}\) plynů, vpravo jen \(\mathrm{2\,mol}\) plynů) - vliv změny teploty:
Uvažujeme vratnou endotermickou reakci:
\(\ce{A + B <=> C + D}\) endotermická reakce \(\left(\ce{\Delta H \gt 0}\right)\) akce: soustavu zahřejeme (zvýšíme teplotu) reakce: dodané teplo se musí spotřebovat, reakce proto běží v tom směru, ve kterém se teplo spotřebovává, tzn. v případě endotermické reakce zleva doprava



