17 Iontová vazba
Iontová vazba je typ chemické vazby, ve které jeden atom získá jeden nebo více elektronů na úkor druhého atomu. Vzniká, pokud rozdíl elektronegativit vázaných atomů je velký; obvykle se uvažuje, že iontová vazba vzniká při rozdílu elektronegativit \(\Delta \chi \gt 1,7\). Atomy se při vzniku iontové vazby snaží získat nebo odevzdat jeden nebo více elektronů tak, aby získaly stabilní elektronovou konfiguraci (viz kap 17.5).
Pojmy:
- Anion
Ion \(\ce{X^{n}-}\) nese záporný náboj a nazývá se anion. Anion prvku vzniká tak, že elektricky neutrální atom přijme jeden nebo více elektronů \(\ce{X + n\ e- -> X^{n}-}\), např. \(\ce{F + e- -> F-}\). Existují také víceatomové anionty, např. \(\ce{SO^{2-}_4}\).
Anionty snadno tvoří prvky umístěné v periodické soustavě prvků vpravo (typicky halogeny – pro ně je vžitý obecný symbol \(\ce{X}\)), zejména prvky umístěné v tabulce vpravo nahoře: \(\ce{F + e- -> F- , Cl + e- -> Cl-}\). Atom přijímající elektrony je elektronegativní, má velkou elektronovou afinitu a bývá to často nekov.
- Kation
Ion \(\ce{Me^{n}+}\) nese kladný náboj a nazývá se kation. Kation prvku vzniká tak, že elektricky neutrální atom ztratí jeden nebo více elektronů: \(\ce{Me - n e- -> Me^{n+}}\), např. \(\ce{Ca - 2 e- -> Ca^{2+}}\). Tentýž děj lze zapsat také takto: \(\ce{Me -> Me^{n}+ + n\ e-}\), např. \(\ce{Ca -> Ca^{2}+ + 2 e-}\). Existují také víceatomové kationty, např. \(\ce{NH_4^+}\). Kationty obvykle tvoří kovy (pro ně je vžité označení \(\ce{Me}\), odvozené od slova metal – kov, z angl.).
Atom odevzdávající elektrony je elektropozitivní, má nízkou elektronegativitu a nízkou ionizační energii. Bývá to kov.
17.1 Oxidačně-redukční (redoxní) děj
REDUKCE je děj, kdy částice přijímá elektrony.
OXIDACE je děj, kdy částice odštěpuje elektrony.
Elektrony, které přijímá elektronegativní atom za vzniku aniontu, se musejí napřed uvolnit z elektronového obalu jiného, elektropozitivnějšího atomu. Ten se při odštěpení elektronů stane kationtem.
Oxidace a redukce vždy běží současně a mluvíme o oxidačně-redukčním (neboli tzv. redoxním) ději:
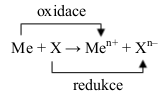
Příklad:

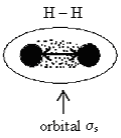
Na rozdíl od vazby kovalentní není iontová vazba směrově specifická (Obr. 17-1). Iontová vazba má elektrostatický charakter, který je všesměrový (tzn. působí na všechny strany stejně), proto ionty mají tendenci shlukovat se do iontových krystalů, které mohou dosahovat i velmi velkých rozměrů (ovšem jen při dostatečné koncentraci krystalizující látky).
 |
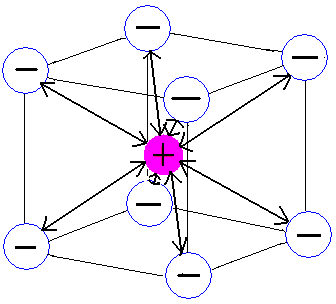 |
| kovalentní vazba (směrově specifická) | iontová vazba (všesměrová) |
17.2 Mřížková energie
Mřížková energie je energie potřebná na rozrušení krystalové struktury (= oddělení iontů) obsahující \(\mathrm{1\,mol}\) iontové sloučeniny a na oddálení iontů do nekonečna. Jinými slovy lze mřížkovou energii definovat také jako energii, která se uvolní při vzniku \(\mathrm{1\,mol}\) iontového krystalu z iontů.
Velikost mřížkové energie lze určit např. výpočtem pomocí tzv. Born-Haberova cyklu (viz kapitola 21.2.2).
Chladicí směsi
Funkce chladicích směsí
Pomocí mřížkové energie se vysvětluje také funkce tzv. chladicích směsí. Podobně jako k přeměně pevné látky na kapalinu je obvykle zapotřebí tepla, je teplo obvykle potřebné také k rozpuštění pevné látky v kapalině (obdoba mřížkové energie, avšak v tomto případě nemusí jít vždy o iontovou sloučeninu a v roztoku od sebe částice rozpuštěné látky nejsou nekonečně vzdálené). Energii potřebnou na rozpouštění odnímá látka svému okolí a soustava se proto během vzniku roztoku ochlazuje.
Využití chladicích směsí
Směsi, které při vzniku ze svých složek snižují svoji teplotu, se v laboratoři mohou využívat k chlazení a nazývají se chladicí směsi. Při použití chladnějšího rozpouštědla dosáhneme nižších teplot. Ještě nižší teploty dosáhneme (v případě vody) při použití sněhu nebo drceného ledu místo kapalné vody. Je také účelné použít tepelně izolující nádobu, abychom dosaženou nízkou teplotu udrželi co nejdéle. Dobrou chladicí směsí je např. ledová tříšť a NaCl. Příklady chladicích směsí uvádí Tab. 28:
| složky chladicí směsi | poměr hmotností složek (ve stejném pořadí jako v předchozím sloupci) | nejnižší dosažitelná teplota |
|---|---|---|
| \(\ce{led-NaCl}\) | \(3:1\) | \(\ce{-20 ^{\circ}C}\) |
| \(\ce{led-KCl}\) | \(1:1\) | \(\ce{-30 ^{\circ}C}\) |
| \(\ce{led-CaCl2}\) | \(2:3\) | \(\ce{-49 ^{\circ}C}\) |
| \(\ce{led-NH4Cl}\) | \(14:1\) | \(\ce{-15 ^{\circ}C}\) |
17.3 Ionty s velkým nábojem, povrchová hustota náboje
Dosud byly v tomto studijním materiálu probrány ionty s „malým“ nábojem, např. \(\ce{Li^{+} , Fe^{3}+ , F-}\) (dle oxidačního čísla nanejvýš do hodnoty 8). Existují ovšem i ionty s mnohem větším nábojem, např. DNA:

 … cukerná složka – ribóza (v RNA) nebo deoxyribóza (v DNA)
… cukerná složka – ribóza (v RNA) nebo deoxyribóza (v DNA)
 … báze DNA (cytosin, guanin, adenin nebo thymin)
… báze DNA (cytosin, guanin, adenin nebo thymin)
 … disociovaná fosforečnanová skupina (každá nese náboj
… disociovaná fosforečnanová skupina (každá nese náboj 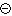 ) – rozepsána pod svorkou
) – rozepsána pod svorkou
\(\ce{n}\) … číslo naznačující opakování základního strukturního motivu polymeru
Celý řetězec DNA obsahuje řádově \(10^{5}\) disociovaných fosforečnanových skupin, z čehož plyne, že celý řetězec je polyanion s nábojem (nábojovým číslem) cca \(100\,000^{\ominus}\).
Částice s velkým počtem atomů či skupin nesoucích záporný náboj (např. \(\ce{- COO-}\), …) se nazývá polyanion (např. DNA, Obr. 17-2). Podobně částice s velkým počtem atomů či skupin nesoucích kladný náboj (např. \(\ce{-NH^{+}4}\) ) se nazývá polykation (např. polypeptid v mírně kyselém prostředí – viz kapitola 19).
Kdyby o chování iontů rozhodoval jen elektrický náboj, musel by polyanion (polykation) být velmi prudce reaktivní. Ve skutečnosti však většina polyaniontů ani polykationtů prudce reaktivní není. Z toho plyne, že chování iontů lépe než celkový elektrický náboj charakterizuje jiná veličina, a to tzv. povrchová hustota náboje \(\boldsymbol\rho\), zavedená vztahem:
| \(\mathrm{\rho}\) | povrchová hustota náboje, |
| \(\mathrm{Q}\) | náboj celé částice, |
| \(\mathrm{S}\) | povrch celé částice |
Protože záporný náboj je po celé délce molekuly DNA (RNA) rozmístěn pravidelně (plyne z Obr. 17-2), je pro všechny molekuly DNA (RNA) povrchová hustota náboje přibližně stejná (nezávislá na celkové délce řetězce a na jeho celkovém náboji). Proto mají všechny molekuly DNA (RNA) přibližně stejné elektrické vlastnosti.
Ze vztahu (17-1) plyne, že mezi stejně nabitými ionty (stejné \(\mathrm{Q}\)) mají největší povrchovou hustotu ionty s nejmenším povrchem (\(\mathrm{S}\)), tj. s nejmenším poloměrem.
Např. pro alkalické kovy:
Vliv povrchové hustoty náboje na hydrataci iontů
Roste-li povrchová hustota kladného náboje, roste ochota kationtů přitahovat částice se zvýšenou elektronovou hustotou (např. s volnými elektronovými páry nebo záporně nabité částice). Takovou částicí je i molekula vody, která na atomu kyslíku nese dva volné elektronové páry a současně také parciální záporný náboj:
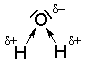
Atom kyslíku z molekuly vody je proto přitahován ke kationtům, např. \(\ce{Li+}\). Jinými slovy – kationty jsou ve vodném roztoku obalovány molekulami vody, naopak anionty k sobě přitahují parciálně kladně nabité atomy vodíku z molekul vody. Říkáme, že ionty jsou hydratovány (popsaný jev se nazývá hydratace). Pokud neuvažujeme konkrétně, které rozpouštědlo jsme použili, mluvíme o solvataci.
Solvatace je jev, kdy jsou ionty v roztoku obalovány molekulami rozpouštědla a nechceme (nebo nemůžeme) odlišovat, o které konkrétní rozpouštědlo se jedná.
Je-li rozpouštědlem voda, mluvíme o hydrataci.
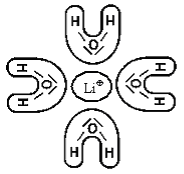 |
Molekuly vody jsou nejsilněji přitahovány ke kationtům s největší povrchovou hustotou náboje. Proto jsou lithné kationty ve skupině kationtů alkalických kovů nejsilněji hydratovány. |
Konkrétní příklady vlivu hydratace na vlastnosti látek:
| \(\ce{LiCl}\) | - | V otevřené zásobní láhvi silně poutá vzdušnou vlhkost, takže po určité době se obsah láhve změní na rozteklou břečku \(\Rightarrow\) láhve s lithnými solemi je proto nutno vždy pečlivě uzavřít a zalepit. |
| \(\ce{NaCl}\) | - | Hydratuje podstatně méně, ale také (viz chování soli na slaném pečivu za deštivého počasí). |
| \(\ce{KCl}\) | - | Hydratace je zanedbatelná. Proto je \(\ce{KCl}\) standardní látkou pro řadu fyzikálně-chemických měření, i když je dražší než \(\ce{NaCl}\). Obecně lze konstatovat, že k přesným chemickým měřením je s ohledem na hydrataci vhodnější používat draselné soli místo sodných. |
17.4 Formální a efektivní (skutečný) náboj
Jak je řečeno v kapitole 12, hranice mezi vazbou polární kovalentní a vazbou iontovou je dána pouze definicí, nejedná se o skutečnou fyzikální hranici. Čistě iontová látka neexistuje, látky jsou pouze více nebo méně polární. To ilustruje následující příklad.
HF má následující rozdíl elektronegativit vázaných atomů: \(\mathrm{\Delta \chi(HF) = \chi(F) - \chi(H) = 4,1 - 2,2 = 1,9}\). Látka je podle definice iontová a měla by tedy být tvořena ionty \(\ce{H+ ,F-}\). Jak je to s elektrickým nábojem přítomným na iontech \(\ce{H+}\) a \(\ce{F-}\) v molekule \(\ce{HF}\)? K řešení této otázky využijeme údaje o dipólovém momentu a délce vazby v molekule \(\ce{HF}\).
Ve skutečnosti je látka \(\ce{HF}\) silně polární a náboj jejích iontů je menší než jednotkový: \(\ce{H^{\delta}+ - F^{\delta}-}\)
\(\MR{\lvert Q_{E}\rvert = 6,987\cdot 10^{-20} C \lt 1,602\,189\,2 \cdot 10^{-19} C}\)
Mluvíme o tzv. efektivním (= skutečném) náboji.
Délka vazby v molekule fluorovodíku je \(\ell = 0,916 \cdot 10^{-10}\ m\). Experimentálně zjištěná hodnota dipólového momentu \(\ce{HF}\) je \(\mu = 6,4 \cdot 10^{-30}\ C\ m\). Vypočítejte velikost efektivního náboje \(\ce{\delta}\) na iontech \(\ce{H+}\), \(\ce{F-}\). Kolikrát je tato hodnota menší než náboj formálně přítomný na uvedených atomech (tzv. formální náboj)?
Dipólový moment \(\mathrm{\vec{\mu}}\) molekuly \(\ce{HF}\) je definován vztahem (viz 12-1):
Po číselném dosazení:
\[\mathrm{6,4\cdot 10^{-30}=\delta_{E}\cdot 0,916\cdot 10^{-10} \Rightarrow \delta_{E} = \dfrac{6,4\cdot 10^{-30}}{0,916\cdot 10^{-10}} = 6,987\cdot 10^{-20}\ C}\]Vypočítaná hodnota je absolutní hodnota efektivního (= skutečného) náboje na iontech \(\ce{H+\ a\ F-}\).
Absolutní hodnota formálního náboje na jednotlivých iontech je \(\mathrm{Q_{T} = \pm 1,602\cdot 10^{−19}\ C}\). Pak:
\[\mathrm{\dfrac{Q_{T}}{\delta_{E}}=\dfrac{1,602\cdot 10^{-19}}{6,987\cdot 10^{-20}}=2,2928\doteq 2,3}\]Efektivní náboj na iontech \(\ce{H+}\), \(\ce{F-}\) v molekule \(\ce{HF}\) je asi \(2,3\times\) menší než náboj formální.
17.5 Stabilní elektronová konfigurace iontů
| – úplně zaplněné | \(\BUDA\quad \BUDA\BUDA\BUDA\quad \BUDA\BUDA\BUDA\BUDA\BUDA\) | |
| – úplně prázdné | \(\BE\quad \BE\BE\BE\quad \BE\BE\BE\BE\BE\) | |
| – zaplněné přesně napůl (každý orbital obsazený jedním elektronem). | ||
| \(\BUA\quad \BUA\BUA\BUA\quad \BUA\BUA\BUA\BUA\BUA\) | ||
Stabilita elektronové konfigurace znamená, že daný atom nebo ion nemá snahu přijímat ani odevzdávat elektrony, takže je odolný vůči oxidaci i redukci.
Naopak – pokud se konfigurace nějaké částice liší od stabilní, snaží se tato částice odebrat nebo předat jiným částicím elektrony tak, aby stabilní konfigurace dosáhla. Chová se tedy jako oxidační nebo redukční činidlo. Čím méně se její konfigurace liší od stabilní konfigurace (tedy čím snadnější je stabilní konfigurace dosáhnout), tím je částice reaktivnější.
Prvními dvěma způsoby je elektronová konfigurace stabilizována velmi výrazně; třetí způsob (poloviční zaplnění valenčních orbitalů) sice konfiguraci také stabilizuje, ale méně.
Pravidla lze kombinovat, např.:
\(\BUDA\quad\BE\BE\BE\) stabilní, \(\BE\quad \BUDA\BUDA\BUDA\BUDA\BUDA\) stabilní, ale \(\BUDA\quad \BUA\BUA\BE\) nestabilní.Nejstabilnější (z hlediska pozice v periodické soustavě prvků) jsou zejména následující konfigurace:
- zcela prázdné valenční orbitaly
konfigurace valenční vrstvy počet valenčních elektronů označení konfigurace příklady iontů \(\ce{0\,e^{-}}\) \(\ce{1s^{0}}\) \(\ce{0}\) 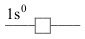
\(\ce{H+}\) - konfigurace vzácných plynů
konfigurace valenční vrstvy počet valenčních elektronů označení konfigurace příklady iontů \(\ce{[He]}\) \(\ce{1 s^{2}}\) 2 elektronový dublet 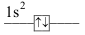
\(\ce{Be^{2}+, Li+, H^{-}}\) \(\ce{[Ne]}\) \(\ce{ns^{2}np^{6}}\) 2+6=8 elektronový oktet 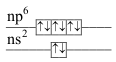
\(\ce{Al^{3}+, Mg^{2}+,\\ Na+, F^{-}, O^{2-}, N^{3-}}\) \(\ce{[Ar]}\) \(\ce{Ti^{4}+, Sc^{3}+,\\ Ca^{2}+, K+, S^{2-}, Cl^{-}}\) \(\ce{[Kr]}\) \(\ce{Se^{2-}, Br^{-}}\) \(\ce{[Xe]}\) \(\ce{Te^{2-}, I^{-}}\) \(\ce{[Rn]}\) \(\ce{At^{-}}\) - konfigurace elektronové osmnáctky
konfigurace valenční vrstvy označení konfigurace příklady iontů \(\ce{[Ni]}\) \(\underbrace{\mathrm{(n-1)s^2(n-1)p^6ns^2(n-1)d^8}}_\text{počet valenčních elektronů}\) \(2+6+2+8=18\) \(\mathrm{(n-1)s^2(n-1)p^6ns^0(n-1)d^{10}}\) elektronová osmnáctka 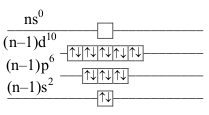
\(\ce{Cu+,\\ Zn^{2}+,\\ Ga^{3}+}\) \(\ce{[Pd]}\) \(\ce{Ag+,\\ Cd^{2}+,\\ In^{3}+,\\ Sn^{4}+,\\ Sb^{5}+}\) \(\ce{[Pt]}\) \(\ce{Au+,\\ Hg^{2}+,\\ Tl^{3}+,\\ Pb^{4}+,\\ Bi^{5}+}\) - konfigurace elektronové dvacítky
konfigurace valenční vrstvy označení konfigurace příklady iontů \(\ce{[Zn]}\) \(\underbrace{\mathrm{(n-1)s^2(n-1)p^6ns^2(n-1)d^{10}}}_\text{počet valenčních elektronů}\) \(2+6+2+10=20\) elektronová dvacítka 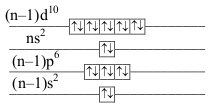
\(\ce{Ga+}\) \(\ce{[Cd]}\) \(\ce{In^{+},\\ Sn^{2}+,\\ Sb^{3}+}\) \(\ce{[Hg]}\) \(\ce{Tl^{+},\\ Pb^{2}+,\\ Bi^{3}+}\) - nepravidelná konfigurace
je obvyklá u iontů přechodných a vnitřně přechodných prvků.
Například:
stabilní konfigurace iontu \(\ce{Fe^{3}+}\) je totožná s konfigurací vanadu: \(\mathrm{[V]}\)
stabilní konfigurace iontu \(\ce{Co^{2}+}\) je totožná s konfigurací manganu: \(\mathrm{[Mn]}\)
Vysvětlení, proč právě tyto konfigurace jsou stabilní, najdete v kapitole 15.2.9.
17.6 Stabilita a reaktivita iontů z hlediska oxidačně-redukčních reakcí
Termíny použité v nadpise této kapitoly byly použity pro zkrácené označení:
stabilní = nereaktivní
nestabilní = reaktivní
Stabilní jsou ionty s konfigurací uvedenou v předchozí podkapitole. Mají-li konfiguraci jinou, jsou obvykle reaktivní. Stabilní jsou zejména anionty malých atomů (např. \(\ce{F-}\) ) a kationty velkých atomů (např. \(\ce{Cs^{+}}\) ).
Anionty
Příčina rostoucí reaktivity aniontů ve směru od malých k velkým je následující:
Reaktivní anion je takový, který snadno ztrácí valenční elektron. Přitom s rostoucí vzdáleností valenčních elektronů od jádra klesá síla, kterou jsou elektrony k atomu poutány (plyne z Coulombova zákona \(\mathrm{\left. F=\dfrac{1}{4\pi \epsilon_0}\cdot\dfrac{Q_1Q_2}{r^2}\right)}\).
| \(\ce{F-}\\\ce{Cl-}\\\ce{Br-}\\\ce{I-}\) |  |
roste síla, kterou jsou \(\ce{e-}\) poutány k jádru |  |
roste reaktivita elektricky neutrálního atomu (poloreakce \(\ce{X + e- -> X-}\)) |  |
klesá síla, kterou jsou \(\ce{e-}\) poutány k jádru |  |
roste reaktivita aniontu (= ochota ztratit \(\ce{e-}\) poloreakcí \(\ce{X- --> X + e-}\)) |
Například:
Valenční elektrony aniontu \(\ce{I-}\) jsou již daleko od jádra, proto anion \(\ce{I-}\) snadno elektrony ztratí. Proto je anion \(\ce{I-}\) reaktivní (poměrně snadno je oxidován na elektricky neutrální jod).
Kationty
Příčina rostoucí reaktivity kationtů ve směru od velkých k malým je následující:
Reaktivní kation je takový, který snadno přijímá valenční elektron. Přitom podle Coloumbova zákona s klesající vzdáleností valenčních elektronů od jádra roste síla, kterou jsou elektrony k atomu poutány. Proto jsou elektrony nejvíce přitahovány k malým kationtům. Ty jsou proto reaktivnější.
| \(\ce{Li+}\\\ce{Na+}\\\ce{K+}\\\ce{Rb+}\\\ce{Cs+}\) |  |
roste síla, kterou jsou \(\ce{e-}\) poutány k jádru |  |
roste reaktivita kationtu (poloreakce \(\ce{Me+ + e- -> Me}\)) |  |
klesá síla, kterou jsou \(\ce{e-}\) poutány k jádru |  |
roste reaktivita neutrálního atomu (= ochota ztratit \(\ce{e-}\)poloreakcí \(\ce{Me - e- -> Me+}\)) |
Například:
Kation \(\ce{Li+}\) má valenční elektrony umístěné blízko jádra \(\Rightarrow\) jádro velmi přitahuje elektrony. Proto je kation \(\ce{Li+}\) reaktivní a poměrně snadno se redukuje na \(\ce{Li^{0}}\). Naopak atom draslíku má svůj valenční elektron dále od jádra než atom sodíku. Proto atom draslíku snadněji svůj valenční elektron ztratí poloreakcí \(\ce{K - e- -> K+}\). Proto např. reakce \(\ce{K + H2O -> KOH + 1/2 H2}\) běží prudčeji než reakce \(\ce{Na + H2O -> NaOH + 1/2 H2}\).
17.7 Poloměry jednoatomových iontů
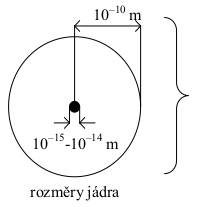 |
rozměry atomového jádra a elektronového obalu jsou řádově: | |
jádro: \(10^{-15}\) až \(\mathrm{10^{-14}\,m}\) |
||
Přirovnání: jádro = špendlíková hlavička obal = létající balón s průměrem \(\mathrm{10\,m}\) |
||
Pozor, výše uvedený obrázek sice působí názorně, ale je zavádějící. Rozměry atomu nelze měřit od jádra „na kraj“, protože elektronový obal atomu má difúzní charakter (není ostře ohraničen). Proto se rozměry atomů (iontů) určují na základě měření vzdálenosti jader tak, jak bylo popsáno v kap. 8.2.3.
Mezijaderná vzdálenost se dá experimentálně určit např. pomocí následujících metod:
- rentgenová difrakce
- NMR (nukleární magnetická rezonance)
- IR (infračervená spektrometrie)
Příklady:
Obr. 17-4: Porovnání velikosti elektronových obalů stejného prvku v závislosti na počtu elektronů v obalu.
Vyznačeno je jádro (černě), core (malý kruh ohraničený čárkovaně) a valenční sféra (vnější kruh ohraničený plnou čarou).
17.8 Deformace a polarizace iontů a vazeb
Tvar atomu je určen tvarem elektronového obalu. Ten může být vlivem vnějšího silového pole různě deformován, takže přestane být symetricky uspořádaný kolem jádra. Tím se od sebe oddělí těžiště kladného a záporného náboje a atom se stane polární částicí. Říkáme, že atom byl polarizován.
Obdobně je možno deformovat molekulové orbitaly, hovoříme pak o polarizaci vazby. Je nutno odlišovat polarizaci a polarizovatelnost atomů od polarizace a polarizovatelnosti vazeb (viz dále).
- Polarizace = stav nerovnoměrného rozložení elektrického náboje v částici, která původně byla nepolární.
- Polarizovatelnost = ochota elektronů v částici dodatečně se přemístit vlivem působení vnějšího elektrického pole.
- Polarizovatelnost atomů je schopnost elektronů atomu se dodatečně přemístit vlivem
působení vnějšího elektrického pole (rozpouštědla nebo reakčního činidla). Tvar atomu se
tím deformuje (Obr. 17-5).
 Obr. 17-5: Znázornění polarizace atomů.
Obr. 17-5: Znázornění polarizace atomů.Polarizovatelnost je kvantifikovatelná fyzikálně chemická veličina. Hodnota polarizovatelnosti atomů souvisí s jejich polohou v periodické soustavě prvků.
- Polarizovatelnost vazeb je schopnost vazebného elektronového páru posunout se dodatečně ještě blíže k elektronegativnějšímu partnerovi vlivem vnějšího elektrického pole
(rozpouštědla nebo reakčního činidla). Přitom dojde k deformaci, případně až ke štěpení
vazby.
Schopnost iontů polarizovat jiné ionty závisí na pevnosti vazby valenčních elektronů k jádru přesně opačně:
Kation \(\ce{H+}\) je málo polarizovatelný, proto má velkou schopnost polarizovat jiné ionty, kation \(\ce{Ag+}\) je naopak snadno polarizovatelný, proto má malou schopnost polarizovat jiné ionty.
17.9 Vlastnosti iontových sloučenin
V pevné fázi jsou ionty poutány na pevné pozice v krystalu, jsou k sobě silně vázány všesměrovou iontovou vazbou (Obr. 17-1). Iontové krystaly jsou proto tvrdé (na rozdíl od krystalů molekulových a vrstevnatých – typy krystalů viz kapitola 20.3.3), mají vysokou teplotu tání i varu (řádově stovky °C), jsou elektricky nevodivé (protože ionty se v pevné fázi nemohou pohybovat) - Tab. 29.
| látka | \(\mathrm{t_\text{tání} (^{\circ}C)}\) | \(\mathrm{t_\text{varu} (^{\circ}C)}\) |
|---|---|---|
| \(\ce{NaCl}\) | 800 | 1440 |
| \(\ce{KCl}\) | 770 | 1470 |
| \(\ce{CaCl2}\) | 774 | 1600 |
Při převodu iontové látky z pevné fáze do kapalné (tání, rozpouštění) dojde k oddělení iontů od sebe (k tzv. elektrolytické disociaci).
Látky schopné podlehnout elektrolytické disociaci nazýváme elektrolyty. Více o elektrolytech viz kapitola 23.2.1.
Ionty se v kapalné fázi (tavenina, roztok) mohou pohybovat z místa na místo. Taveniny i roztoky iontových látek proto vedou elektrický proud.
17.10 Zápis iontových reakcí pomocí chemických rovnic
17.10.1 Neutralizace
Neutralizace bývá v chemii na základní škole definována jako reakce kyseliny se zásadou, při které vzniká sůl a voda. Tato „definice“ je ovšem nesprávná. Skutečnost je taková, že:
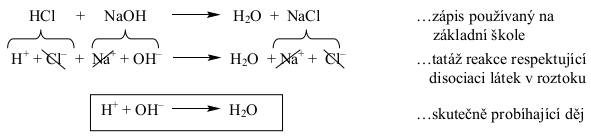
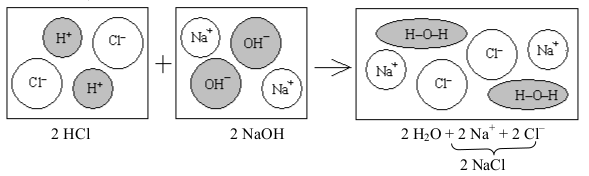
Pouze zarámečkovaná reakce je neutralizace. Žádného jiného iontu v roztoku se neutralizace netýká, ostatní ionty po celou dobu zůstávají přítomny v roztoku beze změny (viz též Obr. 17-6).
17.10.2 Srážecí reakce
Srážecí reakce je spojení kationtu a aniontu v roztoku za vzniku sraženiny málo rozpustné látky.
-
\(\ce{H2SO4 + BaCl2 ->}\) \(\ce{\underbrace{\underline{BaSO4}}_{\tiny} + 2 HCl}\) sraženina Sloučenina \(\ce{BaSO4}\) se používá jako kontrastní látka při rentgenování žaludku, protože se jedná o jednu z mála nerozpustných sloučenin barya. Baryum má velké atomy a proto je vhodné jako kontrastní látka při rentgenování, ale jeho rozpustné sloučeniny jsou velmi toxické. Avšak \(\ce{BaSO4}\) je nerozpustný, proto se nemůže vstřebat do organismu a z toho důvodu je netoxický.Vznik sraženiny je možno vyznačit buď šipkou směřující dolů, tj. \(\ce{BaSO4 v}\) nebo podtržením: \(\ce{\underline{BaSO4}}\). Značení sraženin (stejně jako značení plynů – např. \(\ce{Cl2 ^}\)) není v chemických rovnicích povinné.
Srážecí reakce je v daném případě pouze reakce kationtu s aniontem uvedená v rámečku nebo na Obr. 17-7 v černých oválech. Všechny ostatní ionty v roztoku po celou dobu zůstávají beze změny (viz též Obr. 17-7).
Obr. 17-7: Schématické znázornění mechanismu srážecí reakce (reakce \(\ce{H2SO4}\) s \(\ce{BaCl2}\) ).Podobně tatáž srážecí reakce pro jiné výchozí látky:
-
Obr. 17-8: Schématické znázornění mechanismu srážecí reakce (reakce \(\ce{Na2SO4}\) s \(\ce{BaCl2}\)).
Jiný příklad srážecí reakce:
-
Obr. 17-9: Schématické znázornění mechanismu srážecí reakce (reakce \(\ce{Pb(NO3)2}\) s \(\ce{KI}\)).
Příklad reakce, která je současně neutralizací i srážecí reakcí:
-
Obr. 17-10: Schématické znázornění mechanismu reakce \(\ce{Na2SO4}\) s \(\ce{BaCl2}\).



