18 Kovová vazba
Kovová vazba vzniká mezi atomy kovu v tuhém stavu a je způsobena elektrostatickou přitažlivostí kationtů kovů a volně se pohybujících valenčních elektronů.
Zjednodušeně chápaná kovová mřížka je znázorněna na Obr. 18-1. Předpokládá se, že v krystalu kovu jsou pravidelně uspořádaná jádra atomů kovu (včetně elektronů tzv. core kap. 8), mezi kterými se volně pohybují valenční elektrony, tvořící tzv. elektronový plyn.

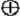 – pravidelně uspořádaná jádra atomů kovu plus core
– pravidelně uspořádaná jádra atomů kovu plus core
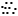 – volně pohyblivé valenční elektrony, pro svou pohyblivost
nazývané u tohoto modelu „elektronový plyn“
– volně pohyblivé valenční elektrony, pro svou pohyblivost
nazývané u tohoto modelu „elektronový plyn“
18.1 Vlastnosti kovů
- Kovy jsou elektricky vodivé (tj. mají nízký měrný elektrický odpor).
Elektrickou vodivost (resp. měrný odpor) kovů a jiných látek srovnává Tab. 30.
Zvýšení teploty způsobí zvětšení amplitudy i frekvence kmitání jader atomů kolem jejich
rovnovážných poloh. Čím více jádra atomů kmitají, tím více překážejí elektronům v jejich
uspořádaném pohybu, proto s rostoucí teplotou elektrická vodivost kovů klesá. Naopak
u polovodičů s rostoucí teplotou elektrická vodivost kovů roste.
Tab. 30: Srovnání měrného elektrického odporu kovů s jinými látkami.
kov měrný odpor \(\left(\ce{\Omega\ m}\right)\) nekov měrný odpor \(\left(\ce{\Omega\ m}\right)\) cín \(0,11 \cdot 10^{–6}\) polyamid (silon) \(10^{10}\) hliník \(0,25 \cdot 10^{–6}\) polystyren \(10^{12}\) hořčík \(0,045 \cdot 10^{–6}\) polypropylen \(10^{13}\) kobalt \(0,06 \cdot 10^{–6}\) polytetrafluorethylen (teflon) \(10^{11}\) měď \(0,0172 \cdot 10^{–6}\) sklo \(10^{8} - 10^{11}\) olovo \(0,2 \cdot 10^{–6}\) slída \(10^{12}\) platina \(0,106 \cdot 10^{–6}\) papír parafinovaný \(10^{14}\) rtuť \(0,984 \cdot 10^{–6}\) porcelán \(10^{12}\) stříbro \(0,0159 \cdot 10^{–6}\) plexisklo \(10^{10}\) Vodivost je převrácenou hodnotou odporu. Vodiče elektrického proudu klasifikujeme (podle typu částic zprostředkujících přenos elektrického náboje) na vodiče 1. druhu a vodiče 2. druhu. Nositeli elektrického náboje u vodičů 1. druhu jsou elektrony, u vodičů 2. druhu přenášejí elektrický náboj ionty. K vodičům 1. druhu patří kovy, k vodičům 2. druhu patří roztoky a taveniny iontových látek. Je důležité si uvědomit, že vodiče 2. druhu jsou v pevném stavu elektricky nevodivé.Měrný elektrický odpor některých kovů v blízkosti absolutní nuly klesá na velmi nízkou, téměř neměřitelnou hodnotu a tím mimořádně roste elektrická vodivost těchto látek. Uvedený jev se nazývá supravodivost. Příkladem supravodivé látky je rtuť při teplotě 4,12 K a nižší.
Kovy jsou tepelně vodivé.
Pojmem „tepelná vodivost“ rozumíme schopnost látek vyměňovat svoji vnitřní energii s okolím, resp. při tepelné výměně předávat část vnitřní energie z teplejšího tělesa na chladnější. Dříve se hovořilo o tzv. „tepelné energii“, v anglosaské literatuře se tento termín dosud používá. Vnitřní energie souvisí s pohybem částic (s rostoucí teplotou se urychluje pohyb částic). Elektronový plyn u kovů je tvořen snadno pohyblivými elektrony, které díky své pohyblivosti snadno přenášejí nejen elektrickou, ale také tepelnou energii. Proto mají kovy dobrou tepelnou vodivost.
Kovy jsou kujné, tažné.
Starší teorie
Pokud působíme na kov mechanickou silou, dojde k přemístění atomů kovu z místa na místo, ale vazebné interakce se prakticky nezmění. Je to jako by se překutálely kuličky (Obr. 18-2). Proto je obvykle možné mechanickým působením měnit tvar kovů, aniž by přitom docházelo k jejich praskání.
 Obr. 18-2: Jednoduché vysvětlení kujnosti a tažnosti kovů (starší teorie).
Obr. 18-2: Jednoduché vysvětlení kujnosti a tažnosti kovů (starší teorie).Novější teorie
Podle novější Frenkelovy teorie je možno tažnost a kujnost kovů vysvětlit pomocí pohybu tzv. dislokací v krystalové mřížce kovu. Dislokací se rozumí určitá porucha nebo nepravidelnost v krystalové mřížce, prostupující značnou částí krystalu a zahrnující proto velké množství atomů.
Na pohybu dislokace se podílejí jen atomy v bezprostřední blízkosti krystalové poruchy. Při jejich kmitání se může jejich vazba (všesměrová) „přehodit“ z původního atomu na sousední, přičemž dojde k posunu dislokace. Tak se celá porucha pohybuje v krystalu za přispění pouze minimální energie. Taktéž celková globální struktura krystalu kovu není narušena, protože pohyb dislokace je spojen pouze se změnami v sousedství dislokace, přičemž všesměrovost kovové vazby způsobuje, že při zániku jedné vazby velmi snadno vzniká v sousedství vazba nová.
Kovy snadno tvoří slitiny. Slitiny se od sloučenin liší tím, že v nich může být kontinuálně proměnný poměr složek. Slitiny klasifikujeme na substituční a intersticiální.
- substituční slitiny
Tyto slitiny vznikají, pokud se poloměry atomů složek slitiny příliš neliší, jen cca do 15 %. Při záměně (substituci) atomů se nemění krystalová mřížka (viz kapitola 20.3.1).
Viz též ATKINS, Peter William, 1940- a JONES, Loretta. Chemical principles: the quest for insight. 2nd ed. New York: W.H. Freman and Company, 2002. xxx, 1030 s. ISBN 0-7167-3923-2., str. 259. Obr. 18-3: Schématické znázornění struktury substituční slitiny.
Obr. 18-3: Schématické znázornění struktury substituční slitiny.(
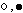 jsou symboly atomů dvou složek slitiny)
jsou symboly atomů dvou složek slitiny)Příkladem takové slitiny je slitina Au-Ag.
Zlato se často slévá s jinými kovy, např. se stříbrem. Dosáhne se tím nejen větší tvrdosti, ale také nižší ceny. Obsah zlata ve slitinách se udává v karátech. Jeden karát odpovídá 1/24 hmotnostních dílů zlata. Čisté zlato má 24 karátů.
Slovo karát pochází z názvu malých semínek svatojánského chleba, která byla ve starověku používána k vážení drahých kovů a kamenů. Slovo karát má dva významy:
a) údaj o čistotě zlata,
b) údaj o hmotnosti (drahých kamenů). V případě drahých kamenů vyjadřuje karát hmotnost, nikoli čistotu a je roven hmotnosti 200 mg. - intersticiální slitiny
název „intersticiální“ má dvě části:
inter = mezi sticium = pozice Znamená to, že „intersticiální slitiny” jsou takové, kde se atomy jedné složky vmezeřují mezi atomy složky druhé (Obr. 18-4). Vznikají v případě, že poloměry složek se liší alespoň o cca 15 %. Základní struktura je mřížka tvořená většími atomy, mezi ně se vmezeřují atomy menší.
 Obr. 18-4: Schématické znázornění struktury intersticiální slitiny.
Obr. 18-4: Schématické znázornění struktury intersticiální slitiny.(
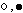 jsou symboly atomů dvou složek slitiny)
jsou symboly atomů dvou složek slitiny)Jiná klasifikace slitin je na homogenní a heterogenní. Homogenní slitiny mají složky rozmístěné pravidelně (mosaz, bronz), zatímco heterogenní se skládají ze směsi krystalických fází různého složení (např. amalgam používaný jako zubní výplň).
Příkladem intersticiální slitiny je ocel (slitina železa a uhlíku). Malé atomy uhlíku se v oceli vnořují mezi velké atomy železa.
Slitin železa a uhlíku je celá řada, avšak ocel vzniká jen za určitých okolností (obsah uhlíku nižší než 2 hmotnostní procenta, dostatečně nízká teplota). Při vyšším obsahu uhlíku má slitina podstatně jiné vlastnosti a nejedná se již o ocel (Obr. 18-5). Obr. 18-5: Fázový diagram systému železo-uhlík pro nízké koncentrace uhlíku.
Obr. 18-5: Fázový diagram systému železo-uhlík pro nízké koncentrace uhlíku.Symboly \(\ce{\alpha, \beta, \gamma\ a\ \delta}\) označují různé fáze železa.
Austenit je tuhý roztok železa \(\ce{\gamma}\) a \(\ce{Fe3 C}\).
S problematikou kovů souvisí řada pojmů, které se snadno spletou. Uvedeme z nich např.:
- intersticiální slitiny (odstavec 4b) × intersticiální sloučeniny (odstavec 5)
- intersticiální sloučeniny (odstavec 5) × intermetalické sloučeniny (odstavec 6)
- vazba kov-kov (odstavec 7) × kovová vazba (kap. 18). Dosud neprobrané pojmy z tohoto přehledu jsou rozebrány v následujícím textu.
- substituční slitiny
- Intersticiální sloučeniny mají podobnou strukturu jako intersticiální slitiny, ale poměr
složek ve sloučeninách je přesně daný (nikoli kontinuálně proměnný jako u slitin). Jsou
vysokotající, tvrdé, elektricky vodivé, kovového vzhledu. Složkami intersticiálních sloučenin (na rozdíl od intermetalických sloučenin) mohou být nejen kovy, ale i nekovy, např.
N, C.
Příklady intersticiálních sloučenin:
- \(\ce{Mo2 N, W2 N, Fe4 N}\) – nitridy
- \(\ce{TiB2}\) – borid titanu
- \(\ce{B4 C, Fe3 C}\) – karbidy
- Intermetalické sloučeniny jsou sloučeniny dvou nebo více kovů, mají definované
stechiometrické složení (celá čísla, ale i velká): \(\ce{Cu31 Sn8 , Ag13 Sb3 , Cu5 Zn8}\). Oxidační čísla
prvků v těchto sloučeninách nemá smysl určovat.
Dvojice kovů spolu mohou tvořit více intermetalických sloučenin. Typickým příkladem intermetalických sloučenin jsou amalgamy (sloučeniny \(\ce{Hg}\) + kov). Známý amalgam je např. \(\ce{HgNa_{x}}\), vznikající při amalgamové elektrolýze roztoku \(\ce{NaCl}\), nebo zubařský amalgam (o složitějším složení).
- Vazba kov-kov
Vazbu kov-kov je nutné pečlivě odlišovat od kovové vazby. Jedná se o zcela jiné interakce.
Vazba kov-kov je pevnější a kratší než kovová vazba (atomy jsou k sobě blíže). Vazba kov-kov je směrově specifická, lokalizovaná mezi dvojice atomů (na rozdíl od vazby kovové, která je všesměrová). Vyskytuje se u některých koordinačních sloučenin.
Příklad:
vazba kov-kov kovová vazba 
\(\ce{l1 \lt l2}\) 
Příklad: \(\left[\ce{Os3 (CO)12}\right]\)
dodekakarbonyltriosmiumPříklad: \(\ce{Fe, Cu, Ag}\) a jiné 
 Obr. 18-6: Srovnání vazby kov-kov a kovové vazby.
Obr. 18-6: Srovnání vazby kov-kov a kovové vazby.
18.2 Pásový model vazby
Výklad v této kapitole je velmi zjednodušený. Jeho cílem je prezentovat pouze všeobecnou představu o existenci pásového modelu a některých s ním souvisejících termínů.
Myšlenka pásového modelu vychází z diagramů MO (viz kapitola 10). Připomeňme si diagram MO dvouatomových molekul (pro zjednodušení uvažujme jen valenční vrstvu, a to pro atomy s 1-2 valenčními elektrony (Obr. 18-7):
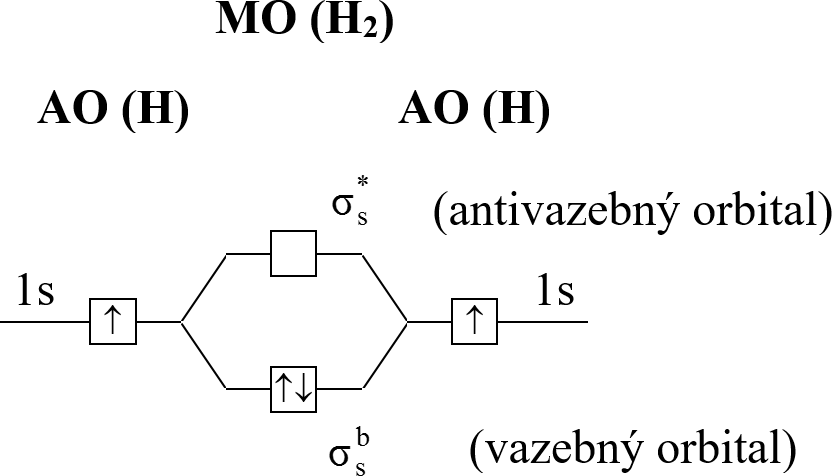
Pro pochopení záznamu tzv. pásového modelu se hodí připomenout, že v diagramech MO (kap. 10.4) se zjednodušeně v knihách někdy sází nikoli rámečky, ale jen příslušná energetická hladina vodorovnou čarou (Obr. 18-8):

V krystalu (který obsahuje velmi mnoho atomů) je na rozdíl od dvouatomové molekuly velmi mnoho AO. Protože spolu navzájem interagují všechny atomy v celém krystalu, v diagramu nejsou izolované vodorovné čáry (energetické hladiny), ale velmi mnoho energetických hladin blízko u sebe, které tvoří celé pásy. Mluvíme pak o tzv. pásovém modelu vazby. „Diagram MO“ kovového krystalu pak lze znázornit tak, jak vystihuje Obr. 18-9, resp. Obr. 18-10.

Stejně jako v diagramu MO mohou být elektrony jen na určitých energetických hladinách (a ne mezi nimi), i v pásovém modelu je oblast energií, které elektrony nemohou mít (tzv. zakázaný pás). Původní AO se v pásovém modelu neznázorňují.
Běžný záznam pásového modelu pak po překreslení střední části diagramu z Obr. 18-9 vypadá zhruba takto (původní AO se v pásovém modelu neznázorňují):

Ve valenčním pásu mohou být nanejvýš 4 valenční elektrony na každý atom. Pokud jsou ve valenčním pásu 1–3 valenční elektrony na atom, jedná se o kov (vodič). Pokud jsou ve valenčním pásu 4 valenční elektrony na atom, jedná se o polovodič \(\left(\ce{Ge, Si}\right)\).
18.2.1 Kovy
U kovů je obsazena pouze část valenčního pásu (může pojmout až 4 valenční elektrony, ale kovy poskytnou nanejvýš 3). Neobsazená část valenčního pásu umožňuje volný pohyb excitovaných valenčních elektronů, což způsobuje dobrou elektrickou vodivost kovů.

18.2.2 Izolátory

18.2.3 Polovodiče
Polovodiče klasifikujeme takto:
- polovodiče vlastní – čisté látky
- polovodiče příměsové – čistý polovodič je upraven tzv. příměsí. Podle typu příměsi dělíme polovodiče na typ \(n\) a typ \(p\).
- vlastní polovodiče: Ge, Si (prvky 14. skupiny, tj. prvky se 4 valenčními elektrony)
Valenční pás vlastních polovodičů je zcela zaplněn, zakázaný pás je úzký. Elektrony z toho důvodu mohou po zahřátí polovodiče přeskočit z valenčního do vodivostního pásu, kde se mohou volně pohybovat. Ve valenčním pásu po nich zbude tzv. kladná díra. Zahřátím proto v polovodiči vzroste počet volně pohyblivých nosičů náboje. Elektrická vodivost polovodičů tedy na rozdíl od kovů s rostoucí teplotou vzrůstá.

- nevlastní (příměsové) polovodiče:
Elektrický proud je v těchto polovodičích veden především jedním ze dvou následujících způsobů:
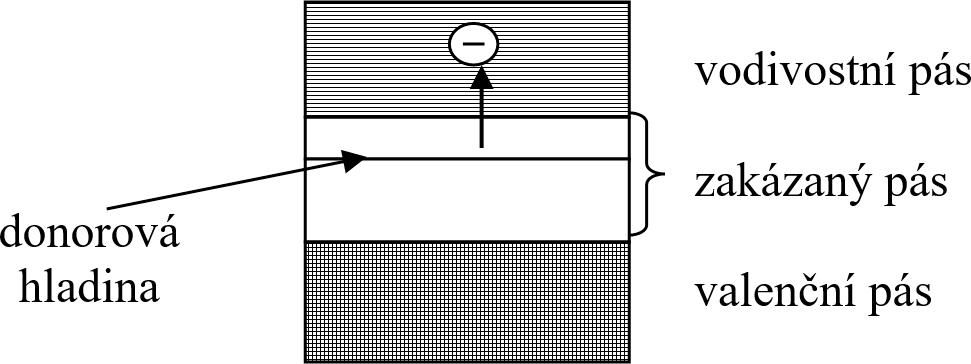
- elektrony na tzv. donorové hladině (polovodiče typu \(n\) – negative)
- kladnými děrami ve valenčním pásu (polovodiče typu \(p\) – positive)
- příměsové polovodiče typu \(n\)
Vodivost je u polovodičů typu n zprostředkována převážně elektrony (odtud označení n – negativní elektrický náboj), jejichž zdrojem (donorem) je příměs z 15. skupiny periodické soustavy prvků (As, Sb). Atomy příměsi mají 5 valenčních elektronů, ale do valenčního pásu lze umístit pouze čtyři elektrony. Pátý elektron se proto volně pohybuje krystalem (vodivostním pásem na tzv. donorové hladině) a podstatně zvyšuje jeho elektrickou vodivost.
Z uvedeného plyne, že hlavními nositeli elektrického proudu jsou u příměsových polovodičů typu \(n\) valenční elektrony příměsi.
- příměsové polovodiče typu \(p\)
Příměs je ze 13. skupiny (např. Al). Tyto prvky mají pouze tři valenční elektrony. To znamená, že každý atom příměsi způsobuje vznik kladné díry (odtud označení p – pozitivní elektrický náboj) ve valenčním pásu. Tyto díry tvoří tzv. akceptorovou hladinu.
Elektrický proud je polovodičem typu \(p\) veden díky přítomnosti kladných děr ve valenčním pásu.

Charakteristické vlastnosti polovodičů
-
Elektrická vodivost polovodičů silně závisí na teplotě:
Při nízké teplotě jsou polovodiče velmi málo vodivé, při vysoké teplotě jsou vodivé podstatně více. Příčinou je skutečnost, že při vyšší teplotě elektrony snadněji překonají zakázaný pás, proto při vyšší teplotě je k dispozici více nosičů elektrického náboje a polovodič je elektricky vodivější.
U kovů je teplotní závislost elektrické vodivosti opačná: elektrická vodivost kovů s rostoucí teplotou klesá (vysvětlení viz kapitola 18.1).
-
Fotoelektrická vodivost polovodičů je projev tzv. vnitřního fotoelektrického jevu:
polovodič pohlcuje fotony přicházející zvenčí a využívá je pro excitaci elektronů do vodivostního pásu. S rostoucí intenzitou osvětlení polovodiče proto jeho elektrická vodivost roste.