6 Modely atomu
Představy o stavbě atomu (stejně jako veškeré lidské poznání) se postupně vyvíjely a zdokonalovaly. Jednotlivé teorie, vystihující představy o stavbě atomu, nazýváme modely.
6.1 Antické představy
V 5. století před naším letopočtem řečtí filosofové Demokritos a Leukippos vyslovili názor, že hmota se skládá z dále nedělitelných částeček, které nazvali atomy (z řec. atomos = nedělitelný). Tento názor pak po dlouhá staletí převládal.
6.2 Daltonova atomová teorie
John Dalton je považován za zakladatele novodobé atomové teorie. Jeho hypotézy, které uvedl na začátku 19. století, jsou pod názvem Daltonova atomová teorie známy dodnes.
Na základě rozboru základních chemických zákonů potvrdil Dalton antickou domněnku, že látky se skládají ze základních stavebních částic – atomů. Zároveň postuloval základní vlastnosti atomů, čímž položil základy atomové teorie. Daltonovy představy o atomární struktuře látky umožnily vysvětlit pozorované chemické zákonitosti a staly se východiskem pro objasnění dalších experimentálních skutečností, zejména z oblasti chemie a fyziky. Daltonovy představy později doplnil Avogadro o pojem molekula.
| Základní postuláty Daltonovy atomové teorie | Potřebné korekce a doplnění podle dnešního stavu vědění |
|---|---|
| Prvky se skládají z velmi malých, dále nedělitelných částic – atomů. | Nedělitelnost atomu je nutno omezit pouze na chemické děje, přičemž neměnné zůstává pouze jádro atomu, které atom identifikuje. Při oxidačně-redukčních dějích, kdy je od atomu odtrhován nebo k němu připojován jeden nebo více elektronů, postulát nedělitelnosti atomu neplatí. |
| Atomy téhož prvku jsou stejné, atomy různých prvků se liší hmotností, velikostí a dalšími vlastnostmi. | Je pravda, že atomy různých prvků se od sebe liší. Atomy téhož prvku se ale také mohou od sebe lišit (různě nabité ionty téhož prvku se liší počtem elektronů v obale; izotopy téhož prvku se liší počtem neutronů v jádře), shoduje se pouze počet protonů v jádře. Počtem protonů v jádře je prvek identifikován (protonové číslo je jednoznačnou identifikací prvku). |
| V průběhu chemických dějů se atomy spojují, oddělují nebo přeskupují, nemohou ale vznikat nebo zanikat. | Existují děje, kdy vznikají jádra prvků; např. při štěpné jaderné reakci z jednoho atomového jádra vznikají dvě. Tyto děje však řadíme k dějům fyzikálním. |
| Slučováním dvou či více prvků vznikají chemické sloučeniny, slučování probíhá jako spojování celistvých počtů atomů těchto prvků. | S tvrzením lze souhlasit, pokud „celistvostí“ budeme chápat celistvost jádra (tj. nebudeme se zabývat chováním elektronového obalu). |
6.3 Thomsonův model
Roku 1897 objevil J. J. Thomson elektron. Objev ho vedl až k formulaci modelu atomu, který zveřejnil roku 1903.
Thomsonovy představy o struktuře atomu můžeme dnes formulovat přibližně takto:
- Hlavní část hmotnosti atomu představuje látka s kladným elektrickým nábojem.
- Hmotnost a kladný elektrický náboj jsou spojitě rozloženy v celém objemu atomu.
- Velmi lehké elektrony jsou umístěny uvnitř této kladně nabité látky v rovnovážných polohách.
- Celkový elektrický náboj kladně nabité látky a elektronů se navzájem kompenzuje.
6.4 Rutherfordův model
V roce 1911 provedl angličan Rutherford významný pokus, při kterém zjistil, že atom je dutý a prázdný, ale uvnitř je nepatrné malé jádro. Na Rutherfordův návrh zkoumali jeho asistenti Geiger a Marsden průchod tzv. paprsků alfa kovovou fólií. Pomocí kolimátoru byl vytvořen úzký svazek částic \(\alpha\), které letěly stejným směrem a dopadaly na tenkou kovovou fólii. Pomocí scintilačního stínítka bylo zjišťováno, kolik částic fólií projde. Většina částic procházela fólií poměrně snadno, avšak menší počet částic se značně odchyloval od původního směru letu nebo se dokonce odrážel zpět před fólii. Výsledky Rutherfordova experimentu bylo možné objasnit na základě představy, že podstatná část hmoty atomu je soustředěna v malém kladně nabitém atomovém jádře.
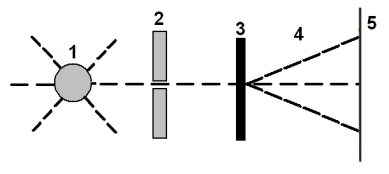
1 zdroj částic \(\alpha\)
2 zařízení vymezující úzký svazek rovnoběžně letících částic \(\alpha\)
3 kovová fólie
4 částice \(\alpha\), které prošly fólií
5 detekce částic \(\alpha\)
V roce 1913 pak Rutherford vystoupil s planetárním modelem atomu, podle kterého:
- Atom se skládá z jádra a obalu.
- V jádře je soustředěna veškerá hmotnost atomu.
- V obalu obíhají elektrony kolem jádra po kruhových drahách.
- Poloměr drah není v Rutherfordově modelu určen, může být libovolný.
- Atom je podle Rutherforda elektricky neutrální, kladný náboj jádra je kompenzován celkovým záporným nábojem elektronů.
Rutherfordův model nevysvětloval stabilitu atomu ani čárový charakter atomových spekter (příklad čárového a pásového spektra ukazuje Obr. 6-4).
I – intenzita záření, λ – vlnová délka záření.
6.5 Bohrův model
Bohrův model atomu vodíku (navržený roku 1913) je zdokonalením Rutherfordova modelu atomu a podobně jako Rutherfordův model využívá zákonitostí klasické mechaniky. Aby Bohr odstranil hlavní nedostatky Rutherfordova modelu, musel postulovat platnost tzv. kvantovací podmínky, kterou nebylo možno odvodit ani vysvětlit pomocí základních zákonů klasické fyziky. Bohrův model atomu vodíku je použitelný i pro tzv. „vodíku podobné ionty“ (tj. pro atomy a ionty s jedním elektronem, např. \(\ce{H,\ He+,\ Li^2+}\)). Neosvědčil se však při výkladu chemické vazby.
Při tvorbě své teorie vycházel Bohr z Planckovy kvantové teorie (1900) a z pokusně získaných emisních spekter. Usoudil, že energie elektronů je kvantována, tzn. může se měnit pouze po určitých dávkách – kvantech, a to při přechodu elektronu z jedné stacionární dráhy (viz dále) na druhou. Tím vystihl základní vlastnost elektronu v atomu – schopnost existovat jen ve stavech s určitou energií a tuto energii měnit pouze ve skocích, nikoli spojitě.
Bohrovy postuláty
- Elektrony se podle Bohrovy teorie mohou pohybovat jen po tzv. stacionárních drahách (tj. po drahách s konstantní energií, což jsou kružnice o určitém poloměru). Elektron na takové dráze má zcela určitou energii, říkáme, že je na určité tzv. energetické hladině. Elektron, který se pohybuje po jedné dráze, nepřijímá ani nevyzařuje energii.
- Pro rozměry drah platí kvantovací podmínka:
\(2\pi m_e rv = nh\tag{6-1}\)
\(\pi\) Ludolfovo číslo \(m_e\) hmotnost elektronu \(r\) poloměr kruhové dráhy pohybu elektronu \(v\) obvodová rychlost elektronu \(n\) označení kvantového čísla (n = 1, 2, 3, 4, 5, …) \(h\) Planckova konstanta - Při přechodu elektronu z dráhy o energii \(E_1\) na dráhu s energii \(E_2\) atom vyzáří nebo přijme energii o velikosti
\(\ce{\Delta E = E2 - E1} = \dfrac{hc}{\lambda}\tag{6-2}\)Při přechodu elektronu od jádra směrem ven atom energii přijímá, při přechodu z vnějšku směrem k jádru energii vyzařuje.
\(\ce{E}\) energie \(h\) Planckova konstanta \(c\) rychlost světla ve vakuu \(λ\) vlnová délka záření vyzářeného nebo přijatého atomem  Obr. 6‑5: Znázornění přechodu elektronu mezi drahami s různou energií.
Obr. 6‑5: Znázornění přechodu elektronu mezi drahami s různou energií.
Vlevo: elektron se vzdaluje od jádra, atom energii přijímá. Vpravo: elektron se přibližuje k jádru, atom energii vyzařuje.
…směr pohybu elektronu,
 …směr pohybu záření (energie) doprovázejícího přesun elektronů,
…směr pohybu záření (energie) doprovázejícího přesun elektronů,  ….… jádro,
….… jádro,  …… elektron
…… elektron
Bohrův model atomu je dnes již překonán. Posloužil však jako jedno z důležitých východisek tehdy vznikající kvantové teorie, která popisuje stav systému (např. i atomu) jiným způsobem, než to činila klasická mechanika. Podle kvantové teorie je neudržitelná představa, že elektron obíhá v atomu po přesně určené dráze (trajektorii), dokonce je nepřijatelná i představa lokalizace elektronu jako částice na konkrétní místo v prostoru.
6.6 Vlnově-mechanický model
Dnešní představu o stavbě atomu vyjadřuje vlnově-mechanický model atomu, který vychází z kvantové teorie. Elektron je v tomto modelu chápán stejně jako všechny částice dualisticky, tj. nejen jako částice, ale také jako vlnění. Kvantová mechanika stav částic, popř. i jiných objektů, popisuje pomocí veličiny zvané vlnová funkce \(\Psi\).
Pravděpodobnost výskytu elektronu (tzv. elektronová hustota) v daném místě v atomu lze podle vlnově-mechanického modelu vypočítat pomocí tzv. Schrödingerovy rovnice (1926):
| \(\mathrm{\hat{H}}\) | tzv. Hamiltonův operátor, |
| \(E\) | celková energie elektronu, |
| \(\Psi\) | vlnová funkce (závisí na prostorových souřadnicích x, y, z a na celočíselných parametrech \(n,\ \ell,\ m\)). |
Hodnota výrazu \(\Psi^2\) má význam pravděpodobnosti výskytu elektronu v daném místě (hovoříme o tzv. elektronové hustotě).
Oblast v atomu, kde pravděpodobnost výskytu elektronu je větší než určitá zvolená hodnota (např. 95 % nebo 99 %), nazýváme orbital.
Typy orbitalů
Rozlišujeme:
- atomový orbital (zkratka AO) je oblast nejpravděpodobnějšího výskytu elektronu v nevázaném atomu (speciálním případem jsou tzv. hybridizované atomové orbitaly, zkratka HAO),
- molekulový orbital (zkratka MO) je oblast nejpravděpodobnějšího výskytu elektronu v chemické vazbě.



